-
己知:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示: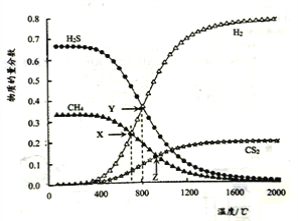
下列说法正确的是
A. 该反应的△H<O
B. X 点CH4的转化率为20%
C. X点与Y点容器内压强比为55:51
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时v(正)<v(逆)
高三化学多选题困难题查看答案及解析
-
25℃时,将V mL 0.10mol·L-1的NaOH溶液逐滴滴入到20.00mL 0.10mol·L-1的醋酸溶液中,溶液pH随所加V(NaOH)的变化而变化(忽略混合时溶液体积变化),数据如下表所示:
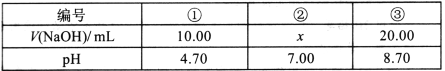
下列说法正确的是
A.①中存在c(CH3COO-)>c(Na+)=0.05mol·L-1
B.②中存在c(CH3COOH)<c(Na+)=c(CH3COO-)=x /(200+10x)
C.③中存在c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.05mol·L-1
D.通过①进行近似计算可知醋酸的数量级是10-6
高三化学多选题困难题查看答案及解析
-
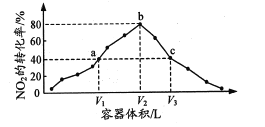
温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和
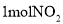 ,发生反应:
,发生反应: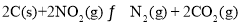 反应相同时间,测得各容器中
反应相同时间,测得各容器中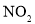 的转化率与容器体积的关系如图所示。下列说法正确的是( )
的转化率与容器体积的关系如图所示。下列说法正确的是( )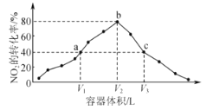
A.T℃时,该反应的化学平衡常数为
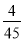
B.图中c点所示条件下,v(正)=v(逆)
C.图中a点所示条件下,v(正)=v(逆)
D.向a点平衡体系中充入一定量的
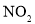 ,达到平衡时,
,达到平衡时,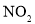 的转化率比原平衡小
的转化率比原平衡小高三化学多选题困难题查看答案及解析
-
已知储氢材料具有可逆吸放氢气的功能。在室温下,块状LaNi5合金与一定压力的氢气发生氢化反应:LaNi5(s)+3H2(g)⇌LaNi5H6(s) ∆H<0;其产物也称为金属氢化物(简记为MH)。现有某金属氢化物镍电池放电反应如下:NiOOH+MH⇌Ni(OH)2+M,其组成是以KOH为电解质,储氢合金MH与Ni(OH)2为电极材料。下列判断错误的是
A.为提高LaNi5合金的储氢能力,可采取加压降温的措施
B.当上述电池放电时,其正极反应为H2O+e-+M=MH+OH-
C.当上述电池充电时,其阴极反应为NiOOH+e-+H2O=Ni(OH)2+OH-
D.上述电池充放电过程中,M的主要作用是担任储氢介质和参与电极反应
高三化学多选题困难题查看答案及解析
-
常温下,向20mL 0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是
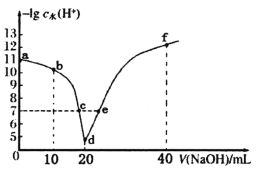
A.从a到d,HA的电离先促进再抑制
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
高三化学多选题困难题查看答案及解析
-
常温下,向二元弱酸H2Y溶液中滴加 KOH 溶液,所得混合溶液的 pH 与 P[P=
或
变化关系如图所示。下列说法正确的是

A.曲线 M 表示
随 pH 的变化关系
B.Ka2 的数值是10-6
C.e 点溶液中:2c(Y2-)+c(HY-)﹣c(K+)+c(OH-)=0.001mol·L-1
D.KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y)
高三化学多选题困难题查看答案及解析
-
温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是
A.T℃时,该反应的化学平衡常数为
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
高三化学多选题困难题查看答案及解析
-
常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
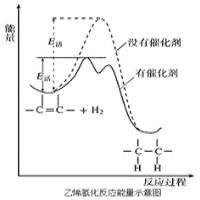
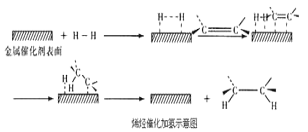
下列说法中正确的是( )
A.乙烯和H2生成乙烷的反应是放热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
高三化学多选题困难题查看答案及解析
-
利用传感技术可以探究压强对2NO2(g)
N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是( )
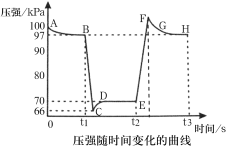
A.B点处NO2的转化率为3%
B.E点到H点的过程中,NO2的物质的量先增大后减小
C.E、H两点对应的正反应速率大小为vH>vE
D.B、E两点气体的平均相对分子质量大小为MB>ME
高三化学多选题困难题查看答案及解析
-
甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
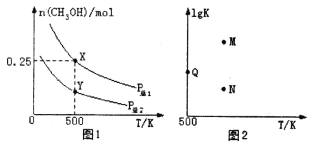
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
高三化学多选题困难题查看答案及解析