-
下列说法正确的是( )
A.油脂有油和脂肪之分,在分类上都属于酯类
B.油脂、蛋白质都是由C、H、O三种元素组成
C.糖类、油脂、蛋白质都是高分子化合物
D.糖类、油脂、蛋白质都能发生水解反应
难度: 中等查看答案及解析
-
诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中丝和泪分别指( )
A.纤维素 油脂 B.蛋白质 烃类 C.淀粉 油脂 D.蛋白质 油脂
难度: 简单查看答案及解析
-
从海水中提取下列物质,可以不涉及化学变化的是 ( )
A.K
B.Mg C.Br2 D.NaCl
难度: 中等查看答案及解析
-
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
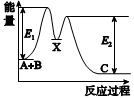
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O (l) △H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:

①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+
O2(g)=CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
难度: 困难查看答案及解析
-
在可逆反应中,改变下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
难度: 简单查看答案及解析
-
反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(L·s)②v(B)=0.6mol/(L·s)
③v(C)=0.4 mol/(L·s)④v(D)=0.45 mol/(L·s)
该反应进行的快慢顺序为( )
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
难度: 中等查看答案及解析
-
可以证明可逆反应N2+3H2
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2
个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体
系压强不再改变;
⑤NH3、N
2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变
;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤
C.④⑤⑦ D.③⑥⑦
难度: 中等查看答案及解析
-
将4 m
ol A气体和2 mol B气体在2L 的容器中混合发生如下反应:2A(g)+B(g)
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是( )
A. 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B. 2s时的压强是起始时的1.1倍
C.
2s时物质A的转化率为30%
D. 2s时物质B的浓度为0.7 mol•L-1
难度: 困难查看答案及解析
-
可逆反应mA(g)+nB(g)
xC(g)在不同温度及压强(p1和p2)条件下反应
物A的转化率的变化情况如图所示。下列判断正确的是( )
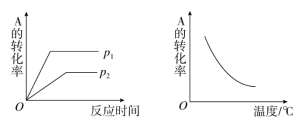
A.正反应吸热,m+n>x B.正反应吸热,m+n<x
C.正反应放热,m+n<x D.正反应放热,m+n>x[
难度: 困难查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )
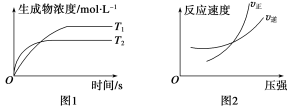
A.a+b>c+d,T1<T2,ΔH<0 B.a+b>c+d,T1>T2,ΔH>0
C.a+b<c+d,T1>T2,ΔH>0 D.a+b<c+d,T1<T2,ΔH<0
难度: 困难查看答案及解析
-
对于平衡体系:mA(g)+ nB(g)
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变
为原来的0.55 倍,则m+n<p+q
B.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
C.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
难度: 困难查看答案及解析
-
在容积为2升的密闭容器中,有反应mA(g)+nB(g)
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为A减少了a mol·L-1,
B的平均反应速度VB=a/15mol·L-1·min-1,C增加了2a/3 mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为( )
A.3︰1︰2︰2 B.1︰3︰2︰2
C.1︰3︰2︰1 D.1︰1︰1︰1
难度: 困难查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0。
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
难度: 中等查看答案及解析
-
在一个密闭容器中进行如下反应:2X2(g)+Y2(g)
2Z(g),反应过程中某一时刻X2、Y2、Z的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能合理的是( )
A.Z的浓度为0.4 mol·L-1 B.X2、Z的浓度均为0.15 mol·L-1
C.X2的浓度为0.4 mol·L-1 D.X2与Z的浓度之和为0.4 mol·L-1
难度: 中等查看答案及解析