-
下列过程没有发生化学反应的是
A.用含硅胶、铁粉的透气小袋与食品一起密封包装
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保存水果
D.用活性炭去除冰箱中的异味
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A.氯化铵、次氯酸都属于强电解质 B.漂白粉、石英都属于纯净物
C.金刚石、白磷都属于单质 D.葡萄糖、蛋白质都属于高分子化合物
难度: 简单查看答案及解析
-
下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH- B.CO和N2 C.HNO2和NO2- D.CH3+和NH4+
难度: 简单查看答案及解析
-
下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是
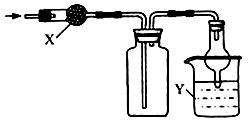
选项
X
收集气体
Y
A
碱石灰
氯化氢
水
B
碱石灰
氨气
水
C
氯化钙
二氧化硫
氢氧化钠
D
氯化钙
一氧化氮
氢氧化钠
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.0.1mol丙烯酸中含有双键的数目为0.1NA
B.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
浓盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
下列说法中正确的是
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g
难度: 简单查看答案及解析
-
盐是一类常用物质,下列物质可直接形成盐的是
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有④⑤⑥
C.只有①②③⑤⑥ D.全部
难度: 中等查看答案及解析
-
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是
A.溶解后的溶液未冷却至室温就转移入容量瓶中
B.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平
C.洗涤烧杯和玻璃棒的溶液转移入容量瓶中
D.定容时,眼睛仰视刻度线
难度: 简单查看答案及解析
-
下列说法正确的是
A.需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀
B.在Fe(OH)3胶体中滴加稀硫酸的现象为:先沉淀后溶解
C.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)===Fe(OH)3↓+3H+
D.在Fe(OH)3胶体中插入两电极通电,在阳极附近颜色加深
难度: 简单查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)<M(乙),则气体的压强:甲>乙
C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
D.若M(甲)<M(乙),则的分子数:甲<乙
难度: 困难查看答案及解析
-
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl―、OH―;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3︰2︰1 B. 2︰3︰1 C. 2︰4︰1 D.4︰2︰1
难度: 困难查看答案及解析
-
将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 困难查看答案及解析
-
甲、乙两种化合物都只含x、y两种元素,甲、乙中x元素的质量分数分别为30.4%和25.9%,若已知甲的化学式是xy2,则乙的化学式只可能是
A.xy B.x2y C.x2y3 D.x2y5
难度: 中等查看答案及解析
-
如图表示一些物质间的从属关系,不正确的是
X
Y
Z
H
A
分散系
胶体
溶液
盐
B
元素周期表的纵行
主族
副族
卤族
C
电解质
酸
碱
盐
D
化合物
共价化合物
离子化合物
酸
难度: 中等查看答案及解析