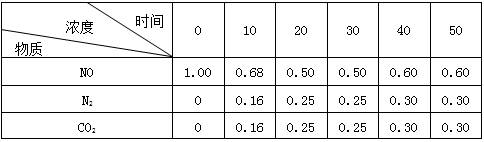
-
下列有关燃料的说法错误的是( )
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
C.氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA
D.0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+= Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量NaOH溶液混合:HCO3-+Na++ OH-=CO32-+ H2O
C.将过量的SO2通入NaClO溶液中:SO2+ClO-+ H2O= HClO+HSO3-
D.将0.2mol•L-1KAl(SO4)2溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3 ↓+ 3BaSO4↓
难度: 困难查看答案及解析
-
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键。下列说法不正确的是( )
A. Q元素形成的酸一定是强酸
B. P与R形成化合物中,阴、阳离子个数比一定为1:2
C. 原子半径:W<R<Q<P
D. 沸点:W2R>W2Q
难度: 中等查看答案及解析
-
镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-

下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质一定是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
向某溶液中加入盐酸酸化的BaCl2溶液
生成白色沉淀
该溶液中不一定含有SO42﹣
B
FeCl2溶液中,滴加KSCN溶液和溴水
滴加KSCN溶液,无明显变化;滴加溴水后,溶液变红
氧化性:Br2>Fe3+
C
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
D
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al
难度: 困难查看答案及解析
-
常温时,下列叙述正确的是 ( )
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低
C.pH均为11的NaOH和NH3·H2O溶液中,水的电离
程度不相同
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
难度: 中等查看答案及解析