-
下列说法不合理的是
A.用分液的方法分离植物油和水的混合物
B.乙烷中含有少量乙烯,提纯乙烷,用酸性高锰酸钾溶液洗气
C.用热的纯碱(Na2CO3)溶液洗涤餐具上的油污
D.粗铜精炼时,粗铜做电解池的阳极,纯铜做阴极
难度: 中等查看答案及解析
-
下列物质中不属于有机物的是
A.碳酸钠(Na2CO3) B.醋酸(CH3COOH)
C.乙炔 D.四氯化碳(CCl4)
难度: 简单查看答案及解析
-
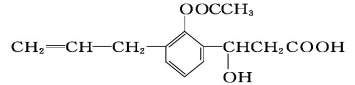
某烃结构式如下:
,有关其结构说法正确的是
A.所有原子可能在同一平面上 B.该分子不存在顺反异构
C.所有碳原子可能在同一平面上 D.1 mol 该烃最多可与4 mol氢气反应
难度: 困难查看答案及解析
-
1 mol某烃在氧气中充分燃烧,需要消耗氧气8mol。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是

难度: 困难查看答案及解析
-
下列所采取的分离方法正确的是
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精
C.苯甲酸中含有少量氯化钠,可用重结晶的方法提纯得到苯甲酸
D.乙炔气体中混有少量硫化氢气体,可以通过足量溴水洗气除去。
难度: 中等查看答案及解析
-
分子式为 C5H12O 的醇与分子式为C4H8O2的羧酸进行酯化反应,生成的酯共有(不考虑立体异构)
A.15 种 B.16 种 C.17 种 D.18 种
难度: 困难查看答案及解析
-
用石墨棒作电极,电解下列物质的水溶液,实质上与电解水一致的是
A.CuCl2 B.NaCl C.CuSO4 D.NaOH
难度: 简单查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl﹣、NO3﹣
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3﹣
C.水电离出来的c(H+)=10﹣12mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+
D.所含溶质为Na2SO4的溶液:K+、HCO3﹣、NO3﹣、Al3+
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H<0,反应物总能量>生成物总能量
B.相同条件下1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2
C.101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1,则H2的燃烧热为571.6 kJ•mol﹣1
D.H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ•mol﹣1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量
难度: 中等查看答案及解析
-
下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1mol AgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
难度: 中等查看答案及解析
-
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-
Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
难度: 困难查看答案及解析
-
下列反应的离子方程式中,不正确的是
A.Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32﹣+2H+═H2SiO3(胶体)
B.用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3﹣═3Ag++NO↑+2H2O
C.(NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42﹣+Ba2++OH﹣═BaSO4↓+NH3•H2O
D.SO2通入氯水中:Cl2+SO2+2H2O═SO42﹣+2Cl﹣+4H+
难度: 中等查看答案及解析
-
下列说法正确的是
A.向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多
D.硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀
难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是
A.8.4g NaHCO3固体中含有的阴阳离子总数为0.2 NA
B.标准状况下,22.4L苯中含有的分子数为NA
C.通常状况下, NA 个甲烷分子占有的体积为22.4L
D.1L物质的量浓度为1mol/L的Na2CO3溶液中,含有CO32-个数为NA
难度: 困难查看答案及解析
-
下列由实验现象得出的结论正确的是:
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。
Ksp(AgCl)< Ksp(AgI)
B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。
Br—还原性强于Cl—
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。
NH4Cl固体可以升华
难度: 困难查看答案及解析
-
部分弱电解质的电离平衡常数如下表,下列说法不正确的是
弱电解质
HCOOH
HCN
H2CO3
NH3·H2O
电离平衡常数
(25 ℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
Kb=1.8×10-5
A.由上表可知酸性HCOOH>H2CO3
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.0.1mol/L的NaHCO3溶液中:c(H2CO3)+ c(H+)= c(OH-)+c(CO32-)
D.结合H+的能力:CO32->HCO3->CN->HCOO-
难度: 困难查看答案及解析
-
下列变化过程中,不能用化学平衡移动原理解释的是
A.H2、I2、HI平衡时的混合气体加压后颜色变深
B.Na2CrO4溶液中滴加稀硫酸,溶液颜色变深
C.红棕色的NO2加压后颜色先变深后逐渐变浅
D.氯气中混有氯化氢,可通过饱和NaCl溶液除去
难度: 中等查看答案及解析
-
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
①NH4+(aq)+
O2(g)=NO2﹣(aq)+2H+(aq)+H2O(l)△H=﹣273kL/mol
②NO2﹣(aq)+
O2(g)=NO3﹣(aq)△H=﹣73kL/mol
下列叙述不正确的是
A.升高温度,可使①②反应速率均加快
B.室温下时0.1mol/LHNO2(aq)pH>1,则NaNO2溶液显碱性
C.NH4+(aq)+2O2(g)═NO3﹣(aq)+2H+(aq)+H2O(l)△H=﹣346kJ/mol
D.1molNH4+在①反应中与1molNO2﹣在②反应中失电子数之比为1:3
难度: 困难查看答案及解析
-
X、Y、Z、W是浓度均为0.01mol/L的溶液,其溶质分别是HCl、NH4Cl、NaOH、NaF中的某一种.室温下,溶液的pH如下表:下列说法正确的是
溶液
X
Y
Z
W
pH
12
2
7.7
5.6
A.将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7
B.四种溶液中,水的电离程度最大的是W溶液
C.将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH﹣)
D.将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10
难度: 困难查看答案及解析
-
在10L恒容密闭容器中发生反应:X(g)+Y(g)⇌2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是
时间/min
n(X)/mol
n(Y)/mol
n(Z)/mol
0
0.20
0.60
0
10
a1
a2
0.25
13
b1
0.45
b2
15
d1
d2
0.30
A.前10 min内的平均反应速率v(Y)=2.5×10﹣3 mol/(L•min)
B.保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10﹣3mol/L
C.若起始时只充入0.60molZ(g),反应达平衡时Z(g)的转化率为50%
D.若起始时充入0.60molX(g)、0.10molY(g)和0.50molZ(g),达到平衡前v(正)>v(逆)
难度: 困难查看答案及解析