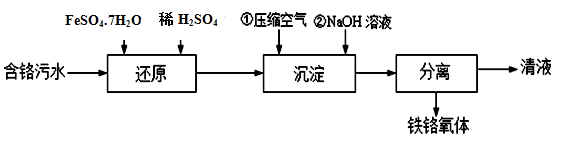
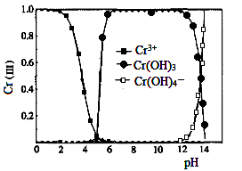
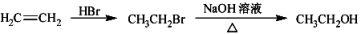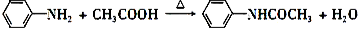-
2015年巴黎气候变化大会召开,旨在保护环境造福人类。下列说法不正确的是
A.扩大铅蓄电池、汞锌锰干电池的生产,满足消费需求
B.采用碳捕集和储存技术,逐步实现二氧化碳的零排放
C.对工业废水、生活污水净化处理,减少污染物的排放
D.催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾
难度: 中等查看答案及解析
-
下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子:
B.溴化铵的电子式:
C.氮原子的结构示意图:
D.间硝基甲苯的结构简式:
难度: 中等查看答案及解析
-
下列说法正确的是
A.Fe在少量Cl2中燃烧生成FeCl2
B.石油的裂解、煤的干馏都是化学变化
C.化学反应的焓变与反应的途径有关
D.等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多
难度: 中等查看答案及解析
-
H2S在O2中不完全燃烧生成S和H2O。下列说法正确的是
A.氧元素的单质存在同素异形体 B.微粒半径:O2-> S2-
C.还原性:H2S<H2O D.该反应中化学能全部转化为热能
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y原子在周期表中处于族序数等于周期序数3倍的位置,Z是最外层电子数最少的金属元素,W与Y属于同一主族。下列叙述正确的是
A.原子半径:W>Z>Y
B.元素W最高价氧化物的水化物为强酸
C.化合物X2Y、Z2Y中化学键的类型相同
D.元素Y的简单气态氢化物的热稳定性比W的弱
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.pH=1的溶液:Ag+、Al3+、Cl-、SO42-
B.能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2-
C.c(OH-)/c(H+)=10-12的溶液:NH4+、Cu2+、NO3-、Cl-
D.水电离产生的c(OH-)=10-12 mol·L-1的溶液:K+、Fe2+、SO42-、NO3-
难度: 中等查看答案及解析
-
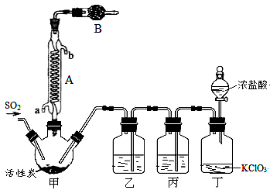
下列实验操作正确的是
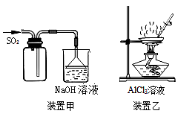
A.用装置甲收集SO2
B.用装置乙制备AlCl3晶体
C.中和滴定时,锥形瓶用待装液润洗
D.使用分液漏斗和容量瓶时,先要检查是否漏液
难度: 简单查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能一步实现的是
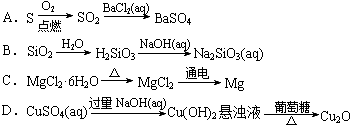
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.用氨水吸收足量的SO2气体:2OH-+SO2=SO32- + H2O
B.NaAlO2溶液中AlO2-的水解:AlO2-+2H2O=Al(OH)3 ↓+OH-
C.加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O
D.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 简单查看答案及解析
-
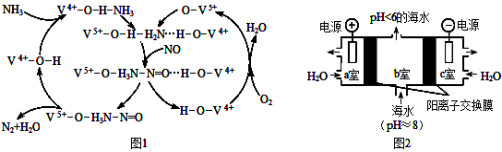
一种微生物燃料电池如图所示,下列关于该电池说法正确的是
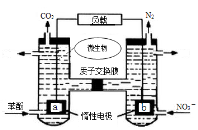
A.a电极发生还原反应
B.H+由右室通过质子交换膜进入左室
C.b电极反应式为:2NO3-+10e-+12H+=N2↑+6H2O
D.电池工作时,电流由a电极沿导线流向b电极
难度: 中等查看答案及解析
-
下列说法正确的是
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.向氨水中不断通入CO2,随着CO2的增加,
不断增大
C.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0
D.合成氨时,其他条件不变,升高温度,反应速率v(H2)和氢气的平衡转化率均增大
难度: 中等查看答案及解析
-
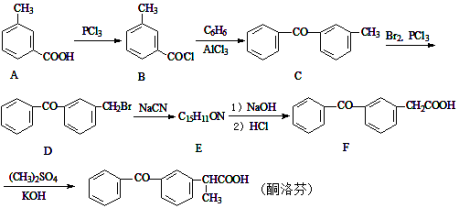
青蒿酸是合成青蒿素的原料,可以由香草醛合成:
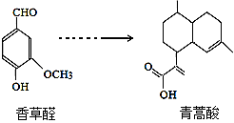
下列叙述正确的是
A.青蒿酸分子中含有4个手性碳原子
B.在一定条件,香草醛可与HCHO发生缩聚反应
C.两种物质分别和H2反应,最多消耗H2 4mol和3mol
D.可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸
难度: 简单查看答案及解析
-
根据下列实验现象所得结论正确的是
选项
实验
现象
结论
A
取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液
溶液未呈蓝色
该食盐中不含有碘酸钾
B
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置
下层溶液显紫红色
Fe3+的氧化性大于I2
C
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液
均有沉淀
蛋白质均发生了变性
D
将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液
白色沉淀逐渐变为蓝色沉淀
Ksp[Cu(OH)2]<Ksp [Mg(OH)2]
难度: 简单查看答案及解析
-
常温下,下列溶液中微粒的物质的量浓度关系正确的是
A.将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-)
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O)
C.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
D.向0.10mol·L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
难度: 困难查看答案及解析
-
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
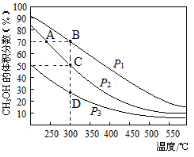
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
难度: 困难查看答案及解析