-
下列说法不正确的是( )
A.二氧化硫可以用于消毒、杀菌
B.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂
C.浓硫酸、浓硝酸均具有强氧化性,常温下均可用铝制容器盛放
D.NH4HCO3受热易分解放出NH3和CO2,可用作制作糕点时的发酵剂、膨松剂
难度: 中等查看答案及解析
-
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.称量时误用“左码右物”
难度: 中等查看答案及解析
-
下列图示内容的对应说明错误
的是( )
A
B
C
D
图示

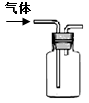
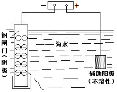
说明
主要成分是蔗糖
做 调 味 剂
该装置可以收集二氧化氮
该装置可
保护钢
闸门不被腐蚀
该仪器用于配制一定质量分数的溶液
难度: 简单查看答案及解析
-
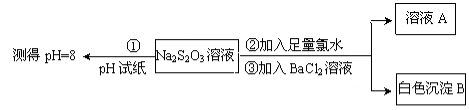
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.25℃,pH=8溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
难度: 中等查看答案及解析
-
解释下列事实的方程式书写正确的是( )
A.加热可增强纯碱溶液去污力:CO32-+2H2O
H2CO3+2OH-
B.用稀硝酸洗涤做过银镜反应的试管:Ag + 4H+ +NO3— = Ag++ NO↑++2H2O
C.向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+ O2+2SO2=2CO2+2CaSO4
D.碳酸氢钠溶液与少量澄清石灰水混合:HCO3-+Ca2++OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.CO和N2为等电子体,22.4 L的CO气体与l mol N2所含的电子数相等
B.在2.4 g石墨中,含C—C共价键数目为0.3NA
C.720 g C60晶体含有0.25NA个晶胞(晶胞如图)

D.1mol[Cu(NH3)4]2+中含配位键4 NA
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.等体积、等密度的CO和C2H4所含原子数相等
B.Na218O2与水反应生成氧气的相对分子质量为34
C.OD-中所含电子数和中子数相等
D.用反应NH3+H3O+=NH4++H2O可以证明NH3比H2O结合质子的能力强
难度: 中等查看答案及解析
-
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
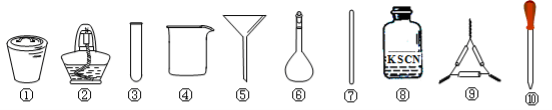
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
难度: 中等查看答案及解析
-
80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4
2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
时间/s
0
20
4
0
60
80
100
c(NO2)/mol·L
-1
0.00
0.12
0.20
0.26
0.30
0.30
下列判断正确的是( )
A.升高温度该反应的平衡常数K减小
B.20~40 s 内,v(N2O4)=0.004 mol·L-1·s1
C.反应达平衡时,吸收的热量为0.30 Q kJ
D.100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
难度: 中等查看答案及解析
-
氧化还原反应实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质甲能使上述还原过程发生。则下列说法中正确的是( )
A.物质甲可能是KMnO4
B.总反应中只体现了硝酸的强氧化性
C.反应中若产生3.0 g 气体,则转移电子数为0.3NA
D.氧化过程的反应式一定为:Cu2O - 2e- +2H+ = 2Cu2+ + H2O
难度: 简单查看答案及解析
-
300℃时,将100 mL由H2O、CO2和N2组成的混合气体,通入到盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时,容器内的压强变为原来的四分之三。则原混合气体中N2的体积分数为( )
A.33.3% B.25% C.50% D.75%
难度: 中等查看答案及解析
-
下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质;
④根据分散系是否具有丁达尔现象将分散系分为
溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥根据元素原子最外层电子数的多少将元素分为金属和非金属。
A.只有②⑥ B.只有②⑤ C.只有②③⑤ D.只有②③④⑤
难度: 中等查看答案及解析
-
根据下列操作及现象,判断所得结论正确的是( )
序号
操作及现象
结论
A
将0.1 mol·L-1氨水稀释成0.01 mol·L-1,测得pH由11.1变成 10.6
稀释后NH3·H2O的电离程度减小
B
常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液
常温下水解程度:
CO32- > HCO3 -
C
向25 mL冷水和沸水
中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色
温度升高,Fe3+的水解程度增大
D
溴乙烷与NaOH乙醇溶液共热产生的气体直接通入KMnO4酸性溶液中,溶液褪色
产生的气体为乙烯
难度: 中等查看答案及解析
-
在一定温度下,向体积恒定为2 L的密闭容器中充入2mol M和一定量的N,发生如下反应:M(g)+N(g)
E(g)。当反应进行到4 min 时达到平衡,测得M的浓度为0.2 mol/L。下列说法正确的是( )
A.4 min时,E的物质的量浓度为1.6mol/L
B.4 min时,用M表示的化学反应速率为0.8mol/(L·min)
C.4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.4 min时,M的转化率为80%
难度: 简单查看答案及解析
-
在复
杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3
B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3
C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+
难度: 困难查看答案及解析
-
证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是( )
A.加入盐酸
B.加入Ba(OH)2溶液
C.测定溶液的pH值
D.加入品红溶液
难度: 简单查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比混合:c(Na+)+
c(H+)=c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 简单查看答案及解析
-
为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应(设两反应分别为反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据。下列有关说法正确的是( )
序
号
液体
固体
混合前温度
混合后最高温度
①
35 mL水
2.5g NaHCO3
20℃
18.5℃
②
35 mL水
3.2g Na2CO3
20℃
24.3℃
③
35 mL盐酸
2.5g NaHCO3
20℃
16.2℃
④
35 mL盐酸
3.2g Na2CO3
20℃
25.1℃
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大
C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2
D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大
难度: 中等查看答案及解析
-
下列各选项中所述的两个量,前者一定大于后者的是( )
A.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液时所加水的量
B.pH=10的NaOH和Na2CO3溶液中水的电离程度
C.相同温度下,10 mL 0.1mol/L的醋酸与100 mL 0.01mol/L的醋酸中H+的物质的量
D.物质的量浓度相等的(NH4)2SO4溶液与(NH
4)2CO3溶液中NH
的物质的量浓度
难度: 困难查看答案及解析
-
关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)= c(CH3C
OO-)+ c(OH-)
B.加入少量CH3COONa固体后,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后溶液显酸性
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.N2(g)+3H2(g)
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
D.吸热反应TiO2 (s)+2Cl2(g)=TiCl4(g)+O2(g)在一定条件下可自发进行,则该反应的ΔS<0
难度: 简单查看答案及解析
-
已知反应X(g)+Y(g)
nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )
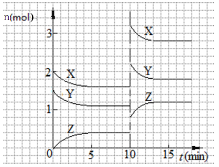
A.反应方程式中n=2
B.该反应的ΔS>0
C.10 min时,曲线发生变化的原因是增大压强
D.0~5min内,平均反应速率v(X)=0.04 mol·L-1·min-1
难度: 简单查看答案及解析
-
某化学研究性学习小组对电解质溶液作出如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)
之比为2:1
③pH相等的四种溶液:a.CH3COONa、b.C6H5ONa、c.NaHCO3、d.NaOH。其溶液物质的量浓度由小到大的顺序为d、b、
c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.③④⑥ B.③⑤⑥ C.④⑤⑥ D.①②④
难度: 简单查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液200 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-) ≥ 0.2mol/L
C.SO42-、NH4+、Fe3+一定存在,
Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析