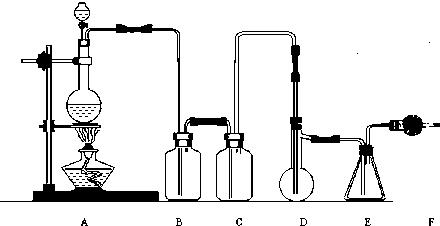
-
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同难度: 中等查看答案及解析
-
分类方法在化学教材必修I中出现,下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
A.①②
B.②④
C.①③
D.③④难度: 中等查看答案及解析
-
物质发生化学变化时,下列量在反应前后肯定不发生变化的是( )
①电子总数 ②原子总数 ③分子总数 ④物质种类 ⑤物质的总质量 ⑥物质的总能量.
A.①②⑤
B.①②③⑤
C.②⑤⑥
D.①④⑤⑥难度: 中等查看答案及解析
-
下列各种仪器:①漏斗;②容量瓶;③锥形瓶;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶.常用于物质分离的是( )
A.①③⑦
B.②⑥⑦
C.①④⑧
D.④⑥⑧难度: 中等查看答案及解析
-
现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是( )
①观察颜色 ②石蕊试液 ③品红溶液.
A.①②③
B.只有①③
C.只有②③
D.只有①②难度: 中等查看答案及解析
-
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A.标准状况下,将1g铝片投入20mL18.4mol/L的硫酸中
B.常温下,向100mL3mol/L的硝酸中加入6.4g铜
C.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
D.将含有产量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃难度: 中等查看答案及解析
-
X、Y为同主族元素,Y的原子半径大于X.下列说法正确的是(m、n均为正整数)( )
A.若Y的最高正价为+7,则X的最高正价一定为+7
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若HnY为气态,则HnX的熔、沸点一定比HnY低
D.若X(OH)n为强碱,则Y(OH)n也一定为强碱难度: 中等查看答案及解析
-
在下述条件下,一定能大量共存的离子组是( )
A.无色透明的水溶液中:K+、Ba2+、I-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+难度: 中等查看答案及解析
-
2007年10月24日,“嫦娥一号”开始了它的探月历程,它的一项重要任务是探测月球表面土壤里的一种非常有用的资源--可控核聚变的原料3He,3He是一种安全高效而又清洁无污染的物质,据统计,月球上的3He可以满足人类1万年以上的供电需求,月球土壤的3He含量可达500万吨.关于3He的叙述正确的是( )
A.3He和4He两种核素互为同素异形体
B.3He和4He两种核素互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数难度: 中等查看答案及解析
-
下列实验操作或仪器的使用图示中正确的是( )
A.
滴加液体
B.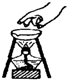
移走加热的蒸发皿
C.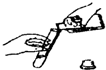
液体药品的取用
D.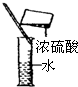
稀释浓硫酸难度: 中等查看答案及解析
-
物质的颗粒达到纳米级时,具有特殊的性质.如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以自燃.下列叙述中正确的是( )
A.常温下,“纳米铜”与铜片的金属性强
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同
D.常温下,“纳米铜”与铜片的氧化性强难度: 中等查看答案及解析
-
下列反应中,调节反应物用量与浓度不会改变反应产物的是( )
A.SO2通入石灰水
B.NaOH溶液滴入NaHCO3溶液
C.硫酸中加入锌粉
D.AlCl3溶液中滴入NaOH溶液难度: 中等查看答案及解析
-
某晶体的水溶液中加入Fe2+的溶液,再加稀HNO3溶液立即变红;另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是( )
A.KSCN
B.NH4SCN
C.NH4Cl
D.FeCl3难度: 中等查看答案及解析
-
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在
C.通入Cl2后,溶液变为棕黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-难度: 中等查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
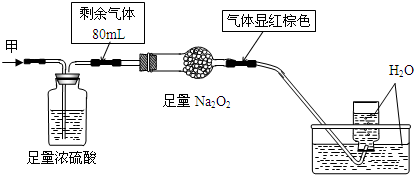
A.NH3、NO2、N2
B.NH3、NO、CO2
C.NH3、NO2、CO2
D.NO、CO2、N2难度: 中等查看答案及解析
-
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
A.NO2
B.N2O2
C.N2O
D.N2O4难度: 中等查看答案及解析
-
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向Fe(OH)3悬浊液中加入HI:Fe(OH)3+3H+=Fe3++3H2O
B.碳酸氢钙溶液加以醋酸中:Ca(HCO3)2+2CH3COOH=Ca++2CH3COO-+2CO2↑+2H2O
C.氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3+3NH+4
D.水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+难度: 中等查看答案及解析
-
某集气瓶内装的混合气体呈红棕色,加入足量蒸馏水,盖上玻璃片振荡得橙黄色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,该混合气体可能是( )
A.N2、NO2、Br2
B.NO2、NO、N2
C.NO2、NO、O2
D.N2、O2、Br2难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2胶体中逐滴加入过量的稀盐酸;③向AgNO3溶液中逐滴加入过量氨水;④向硅酸钠溶液中逐滴加入过量的盐酸( )
A.①②
B.①③
C.①④
D.②③难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.46gNO2和N2O4混合气体中含有的原子总数为3NA
B.用含4molHCl的浓盐酸跟足量二氧化锰反应,生成的氯气在标准状况下的体积22.4L
C.0.1mol金属钠与氧气在一定条件下发生反应,生成氧化钠和过氧化钠的混合物时,失去的电子数不一定为0.1NA
D.1L1mol•L-1硫酸铁溶液中含有Fe3+离子数目为0.2NA难度: 中等查看答案及解析
-
将氯化铝溶液和氢氧化钡溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原氯化铝溶液和氢氧化钡溶液的物质的量浓度之比可能是( )
A.1:3
B.2:3
C.1:4
D.4:3难度: 中等查看答案及解析