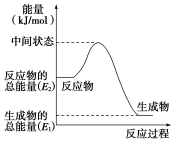
-
可使C(s)+ CO2(g)=2CO(g)反应速率增大的措施是( )
①增大压强 ②增加炭的量 ③通入CO2
④恒压下充入N2 ⑤恒容下充入N2 ⑥升温
A.①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.SO2 C.(NH4)2CO3 D. Cl2
难度: 简单查看答案及解析
-
下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.在稀溶液中,H+(aq)+ OH−(aq)=H2O(l);△H=﹣57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
C.由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨比金刚石稳定
D.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ/mol
难度: 中等查看答案及解析
-
室温下,水的电离达到平衡H2O
H++OH−。下列叙述正确的是( )
A.加热,平衡向正反应方向移动,Kw不变
B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH−)降低
D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH−)=c(H+)
难度: 中等查看答案及解析
-
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中
值增大,可以采取的措施是( )
A.加少量烧碱固体 B.降低温度 C.加少量冰醋酸 D.加水
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应为放热反应,为提高NH3的产率,理论上应采取低温的措施
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
难度: 困难查看答案及解析
-
高温下,某可逆反应达到平衡,其平衡常数为K=
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
A.该反应的焓变为正值
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO(g)+H2O(g)
CO2(g)+H2(g)
难度: 中等查看答案及解析
-
下列化学用语的描述正确的是( )
A.氨水显碱性:NH3·H2O=NH4+ + OH−
B.硫酸氢钠溶液显酸性:NaHSO4=Na+ + H+ + SO42-
C.Na2S溶液显碱性:S2- + 2H2O
H2S + 2OH-
D.AlCl3溶液显酸性:Al3+ + 3H2O
Al(OH)3↓ + 3H+
难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是( )
A.常温下c(OH−)/c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32-
B.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
C.常温下由水电离出来的c(H+)=1×10-13mol/L的溶液中:K+、CO32-、Cl-、NO3-
D.常温下,Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S 稀溶液中,c(H+)=c(OH−)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项
实验操作及现象
实验目的或结论
A
向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快
证明FeCl3溶液的催化效率更高
B
硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失
证明非金属性:Cl>Si
C
测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
证明盐酸酸性比醋酸强
D
取5 mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色)
证明:
Ksp(AgI) <Ksp(AgCl)
难度: 困难查看答案及解析
-
室温向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10ml pH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是( )
A.AgCl的悬浊液中通入少量HCl,c(Ag+)减小
B.AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360
C.AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成
D.等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
难度: 中等查看答案及解析
-
某温度下,向pH=6的纯水中加入NaHSO4 晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性
D.NaHSO4晶体的加入抑制了水的电离
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH−)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则c(M+)=c(A-)
D.0.1 mol/L的 NaHA 溶液pH=1则c(Na+)=c(H2A)+c(HA-)+c(A2-)
难度: 困难查看答案及解析
-
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100 mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
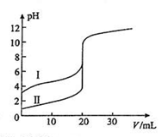
A.Ⅱ表示的是滴定盐酸的曲线
B.pH=7时,滴定盐酸消耗V(NaOH)大于滴定醋酸消耗V(NaOH)
C.V(NaOH)=20ml时,c(Cl-)=c(CH3COO-)
D.V(NaOH)=10ml时,醋酸溶液中:
c(CH3COO- )>c(Na+ )> c(H+ )> c(OH−)
难度: 中等查看答案及解析
-
有4种混合溶液,分别由等体积0.1 mol/L的两种溶液混合而成:
①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)
下列各项排序正确的是( )
A.pH:②<①<③<④ B.溶液中c(H+):①<③<②<④
C.c(NH):①<③<②<④ D.c(NH3·H2O):①<③<④<②
难度: 困难查看答案及解析