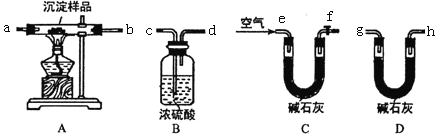
-
下列实验操作及现象,能推出相应结论的是
选项
实验操作及现象
结论
A
常温下,用pH计测得0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,前者大
酸性:CH3COOH>HClO
B
向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生
淀粉没有水解
C
向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成;再滴加CuCl2溶液,有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
D
向Fe(NO3)2样品,溶于稀硫酸,滴加KSCN溶液,溶液变红
Fe(NO3)2样品溶于稀硫酸前已氧化变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
“一带一路”贸易使国外的特色产品走入百姓的日常生活。下列商品的主要成分所对应的材料类型不正确的是

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将1mol Cl2通入到含1mol FeI2溶液中:
2Fe2++2I﹣+2Cl2═2Fe3++4Cl﹣+I2
正确;
Cl2过量,可将Fe2+、I﹣均氧化
B
1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O
正确;AlO2﹣与Al(OH)3消耗的H+的物质的量之比为2:3
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO﹣═HClO+HSO3﹣
正确;
说明酸性:H2SO3强于HClO
D
Mg(HCO3)2溶液与足量的NaOH溶液反应:
Mg2++HCO3﹣+OH﹣═MgCO3↓+H2O
正确;
酸式盐与碱反应生成正盐和水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共0.8 mol,这些气体恰好能被600mL 2.0mol·L-1NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则被Cu还原的硝酸的物质的量为
A. 0.6 mol B. 0.8 mol C. 1 mol D. 1.2 mol
难度: 中等查看答案及解析
-
a、b、c 、d、e为原子序数依次增大的五种短周期主族元素。已知a、d 同主族,c、e同主族,且a、d的原子序数和为c、e原子序数和的一半;b与c可以形成两种或两种以上化合物。下列说法正确的是
A. 离子半径:d>e>b>c>a
B. 气态氢化物稳定性:b>c,e>c
C. 由a、b、c、d四种元素来构成的化合物的水溶液可能显酸性也可能显碱性
D. c、d形成的两种常见离子化合物中阴阳离子个数比一定是2∶1
难度: 中等查看答案及解析
-
已知链烃A 的分子式为C6Hx,它与足量的溴水反应生成C6HxBr2,该生成物中含有两个甲基,则满足上述条件(不考虑立体异构)的链烃A的结构有
A. 5种 B. 6种 C. 7种 D. 9种
难度: 中等查看答案及解析
-
根据下列各图曲线表征的信息,得出的结论不正确的是
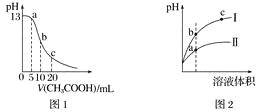

A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
难度: 困难查看答案及解析
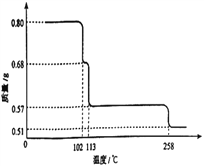
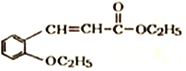 )是合成高分子化合物M的单体,H可以通过有机物A (分子式为C7H8O) 和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A (分子式为C7H8O) 和丙酮为原料来进行合成,E为中间产物(结构简式为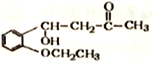 )其合成路线如图:
)其合成路线如图: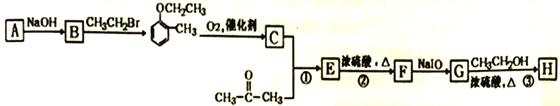

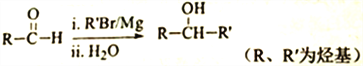 ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成 ,此合成路线为
,此合成路线为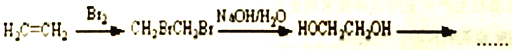 ,请完成接下来的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上下注明试剂和反应条件)。____________
,请完成接下来的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上下注明试剂和反应条件)。____________