-
下列燃料中,不属于化石燃料的是
A.煤 B.石油 C.天然气 D.水煤气
难度: 简单查看答案及解析
-
氢氧化钠与盐酸的反应属于
A.吸热反应
B.放热反应
C.既是吸热反应也是放热反应
D.都不是
难度: 简单查看答案及解析
-
.在溶液中发生的反应,对反应速率不发生影响的因素是
A.温度 B.压强 C.浓度 D.催化剂
难度: 简单查看答案及解析
-
对于放热反应
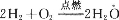 ,下列说法正确的是
,下列说法正确的是A.产物H20所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和02具有的能量相等
难度: 中等查看答案及解析
-
已知热化学方程式: 2H2(g) + O2(g) = 2H2O(g) △H1=-483.6kJ/mol,则对于热化学方程式:2H2O(l) === 2H2(g) + O2(g) △H2下列说法正确的是
A.热化学方程式中化学计量系数表示分子个数
B.该反应的△H2=+483.6kJ/mol
C.︱△H2|<︱△H1|
D.︱△H2|>︱△H1|
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B.在101kPa时1mol物质燃烧时放出的热量叫做该物质的燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。
难度: 中等查看答案及解析
-
对于密闭容器中进行的反应:P(g)+ Q(g)
R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是
A、P、Q、R、S的浓度相等
B、P、Q、R、S在密闭容器中共存
C、P、Q、R、S的浓度不再变化
D、用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等
难度: 中等查看答案及解析
-
在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(固)+3B(气)
2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色)
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色
难度: 中等查看答案及解析
-
一定条件下,可逆反应C(s)+CO2(g)
2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度;
②增加反应物C的用量;
③缩小反应体系的体积;
④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①② C.①③ D.①③④
难度: 中等查看答案及解析
-
下列关于化学平衡常数的说法,
A.在任何条件下,化学平衡常数都是一个定值.
B.改变浓度,平衡常数会变
C.同条件下,平衡常数只与温度有关.
D.化学平衡发生移动,平衡常数必定发生改变.
难度: 简单查看答案及解析
-
下列说法中正确的是
A.0.1mol/L HCl和0.1mol/L H2SO4分别与2mol/LNaOH溶液反应速率相同
B.大理石块与大理石粉分别同0.1mol/L盐酸反应速率相同
C.Mg、Al在相同条件下分别与0.1mol/L盐酸反应,其反应速率相同
D.0.1mol/L HCl和0.1mol/LHNO3与相同形状和大小的大理石反应,速率相同
难度: 中等查看答案及解析
-
合成氨所需的氢气由煤与水发生反应制得,其中一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g);△H<0,要使CO转化率提高,可采用下列措施中的
A.增大水蒸气的浓度 B.增大CO的浓度
C.升高温度 D.增大压强
难度: 中等查看答案及解析
-
可逆反应aX(g)+bY(g)
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图象如图。则下列说法中正确的是
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
难度: 中等查看答案及解析
-
已知下列两个热化学方程式
2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJ/mol
C3H8(g) +5O2(g) = 3CO2(g) + 4H2O(l);△H =-2220.0kJ/mol
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是
A.1:3 B.3:1 C.1:4 D.1:1
难度: 中等查看答案及解析
-
反应2A+3B=C+2D在2L的密闭容器中进行,半分钟后,C的物质的量增加了0.3 mol,则此反应的平均速率表达正确的是
A.v(C)=0.01 mol·L-1·s-1
B.v(B)=0.03 mol·L-1·s-1
C.v(A)=0.01 mol·L-1·s-1
D.v(D)=0.02 mol·L-1·s-1
难度: 中等查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) == 2H2O(1),△H=―285.8kJ/mol
B.2H2(g)+ O2(g) == 2H2O(1),△H=+571.6 kJ/mol
C.2H2(g)+O2(g) == 2H2O(g),△H=―571.6 kJ/mol
D.H2(g)+
O2(g) == H2O(1),△H=―285.8kJ/mol
难度: 中等查看答案及解析
-
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
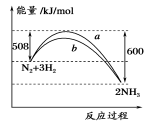
A.加入催化剂,该化学反应的反应热改变
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2+3H2
2NH3,ΔH=-92 kJ/mol
D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
难度: 中等查看答案及解析
-
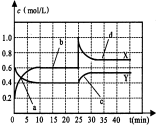
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g);ΔH <0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A.t5时增大了压强
B.t3时降低了温度
C.t2时加入了催化剂
D.t4~t5时间内转化率一定最低
难度: 中等查看答案及解析
-
下列事实不能用勒沙特列原理解释的是
A.用排饱和氯化钠溶液的方法收集氯气
B.加催化剂,在一定条件下使N2和H2转化为NH3
C.加压有利于SO2与O2反应生成SO3
D.可用浓氨水和氢氧化钠固体来快速制取氨气
难度: 中等查看答案及解析
-
对于密闭容器中进行的反应:2NO2
N2O4,下列说法正确的是
A.增大NO2的浓度,平衡常数增大
B.增大N2O4的浓度,平衡常数增大
C.增大NO2的浓度,正反应速率加快,逆反应速率减慢
D.增大NO2的浓度,平衡常数不变
难度: 中等查看答案及解析