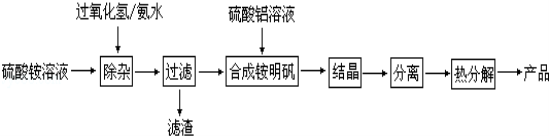
-
近年来我国很多城市发生严重的雾霾天气,对人们的健康造成威胁,下列有关环境问题的说法不正确的是
A.改进汽车尾气净化技术,可以减少大气污染物的排放
B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气产生的主要原因
C.推广燃煤脱硫技术,可以降低S02对大气的污染
D、CO、S02、NO、N02都是对大气产生污染的气体,它们在空气中都能稳定存在
难度: 中等查看答案及解析
-
取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示。A、B、C、D四个气球内,与CO所含原子数一定相等的是
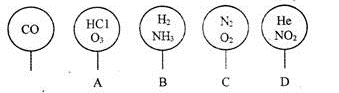
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述中正确的是
A.在18 g 18O2中含有NA个氧原子
B.1 mol FeI2与足量氯气反应对转移的电子数为2
C.1 mol Cl2参加反应转移电子数一定为2 NA
D.标准状况下,2.24L四氯化碳含有分子数目为0.1
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-===AlO2-+2H2O
B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+=I2+2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
D.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
难度: 中等查看答案及解析
-
下列各项中的事实能用同一原理解释的是
A.明矾和氯水都用于自来水的处理
B.干冰和碘化银都可用于人工降雨
C.向Fe(OH)3胶体和NaAlO2溶液中逐滴加盐酸,先出现沉淀,然后溶解
D.铁器和铝制容器都可以用来运输浓硫酸
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A.由水电离的c(OH-)=10-12mol·L-1的溶液中:Br-、CO32-、K+、SO32-
B.含有大量AlO2-的溶液中:K+、Al3+、Br-、SO42-
C.和Al反应放出氢气的溶液:Na+、Cl-、NH4+、NO3-
D.使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO42-
难度: 中等查看答案及解析
-
热还原法冶炼金属的反应一定属于
A.置换反应 B.氧化还原反应 C.分解反应 D.复分解反应
难度: 简单查看答案及解析
-
在给定条件下,下列画线物质在化学反应中能被完全消耗的是
A.用浓盐酸与二氧化锰共热制氯气
B.标准状况下,将1 g铝片投入20 mL 18 mol·L-1硫酸中
C.向100 mL 4 mol·L-1硝酸中加入5.6 g 铁
D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用氮气和氢气合成氨
难度: 简单查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+ = Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论错误的是
选项
实验操作
实验现象
结论
A
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2 min后,试管里
出现凝胶
酸性:盐酸>硅酸
B
向蛋白质溶液中滴加饱和CuSO4溶液
有固体析出
蛋白质发生变性
C
常温下,向浓硫酸中投入铁片
铁片不溶解
常温下,铁不与浓硫酸反应
D
向某溶液中先滴加KSCN溶液,
再滴加少量氯水
先无明显现象,
后溶液变成血红色
溶液中含有Fe2+,没有Fe3+
难度: 中等查看答案及解析
-
有Fe2+、NO3—、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.氧化剂和还原剂的物质的量之比为1:8
B.每1molNO3—发生氧化反应,转移8mol e-
C.该过程说明Fe(NO3)2溶液不宜加酸酸化
D.若把该反应设计为原电池,则负极反应为Fe2+—e–=Fe3+
难度: 中等查看答案及解析
-
下列实验过程中产生沉淀的物质的量(Y) 与加入试剂的量(X)之间的关系正确的是

A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为AlCl3,则丁可能是NaOH
C.若甲为Fe,则丁可能是氯气
D.若甲为NaOH 溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗 x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为
A. (y-2x)/a mol/L B. (y-x)/a mol/L
C. (2y-2x)/a mol/L D. (2y-4x)/a mol/L
难度: 中等查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 困难查看答案及解析
-
下列实验不合理的是
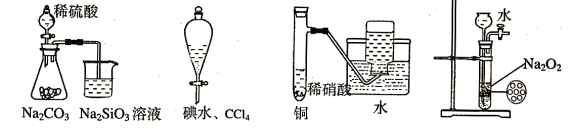
A.证明非金属性强弱 S>C>Si B.四氯化碳萃取碘水中的碘
C.制备并收集少量NO气体 D.制备少量氧气
难度: 简单查看答案及解析
-
24 mL 0.05 mol/L的 Na2SO3恰好与20 mL 0.02 mol/L的K2R2O7溶液完全反应,则R元素在还原产物中的化合价为
A.0 B.+2 C.+3 D.+6
难度: 中等查看答案及解析
-
把7.4g Na2CO3·10H2O和NaHCO3组成的混合物溶于水,配成100 mL溶液,其中c(Na+)=0.6 mol·L-1。若把等质量的混合物加热到恒重时,残留物的质量是
A.3.18 g B.2.21 g C.5.28 g D.4.22 g
难度: 中等查看答案及解析