-
产生下列现象与向大气中排放的物质无关的是( )
A.闪电
B.酸雨
C.臭氧层空洞
D.温室效应难度: 中等查看答案及解析
-
根据下图所示实验分析得出的结论中,不正确的是( )
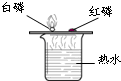
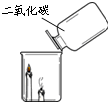
A.甲烷燃烧生成二氧化碳和水 B.铁能在氧气中燃烧 C.白磷的着火点比红磷的低 D.二氧化碳的密度比空气大,
不燃烧也不支持燃烧
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列曲线正确的是( )
A.
向稀硝酸中加水
B.
双氧水分解
C.
向等体积、等浓度的稀盐酸中加金属
D.
向稀硫酸中滴BaCl2溶液难度: 中等查看答案及解析
-
下列关于物质的性质和用途说法不正确的是( )
A.二氧化碳用于灭火,是利用它的物理性质和化学性质
B.氮气用来保护粮食,是利用氮气常温下化学性质稳定
C.稀有气体充人霓虹灯,是利用稀有气体通电能发出不同颜色的光
D.氧气用于火箭发射,是利用氧气的可燃性难度: 中等查看答案及解析
-
下列说法正确的是( )
①向某无色溶液中滴加紫色石蕊试液变蓝色,说明该溶液呈碱性
②铜丝浸入硝酸汞溶液中,表面覆盖一层银白色的物质,说明铜比汞活泼
③在某固体中滴加稀盐酸,有气泡产生,说明该固体是碳酸盐
④向某无色溶液中滴加氯化钡溶液,产生白色沉淀,说明该溶液是硫酸溶液
⑤将白醋滴在润湿的pH试纸上,测定其pH
⑥用氢氧化钠溶液除去CO2中的HCl气体
⑦用BaCl2溶液除去KNO3溶液中少量的K2SO4
⑧分离CaCl2、CaCO3的混合物,主要操作为溶解、过滤、蒸发等.
A.①②⑧
B.②③⑤
C.③④⑥
D.①④⑦难度: 中等查看答案及解析
-
如图为甲、乙、丙三种物质的溶解度曲线.下列说法正确的是( )
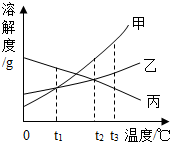
A.在t1℃时,溶解度甲=乙>丙
B.从乙饱和溶液中析出较多量的晶体通常可采用降温结晶法
C.等质量的甲、乙饱和溶液从t3℃降温到t1℃,析出晶体(无结晶水)的质量甲>乙
D.t2℃时,将乙、丙的饱和溶液升温至t3℃,乙溶液的质量分数增大,丙溶液的质量分数减小难度: 中等查看答案及解析
-
下列物质的用途是利用其化学性质的是( )
A.用干冰人工降雨
B.稀硫酸除铁锈
C.活性炭除去冰箱内的异味
D.金刚石刻划玻璃难度: 中等查看答案及解析
-
由物质分类知识可知,属于同一类物质的一组是( )
A.红磷、医用酒精、纯碱
B.食盐水、葡萄糖、矿泉水
C.食醋、液氧、酱油
D.空气、海水、石油难度: 中等查看答案及解析
-
下列化学实验操作正确的是( )
A.
制取H2
B.
给溶液加热
C.
稀释浓硫酸
D.
熄灭酒精灯难度: 中等查看答案及解析
-
2008年9月,三鹿婴幼儿奶粉因添加三聚氰胺(C3H6N6)致使一些婴幼儿患肾结石病.下列关于三聚氰胺的说法正确的是( )
A.三聚氰胺由碳、氢、氮三个元素组成
B.三聚氰胺中碳、氢、氮质量比为1:2:2
C.三聚氰胺中氮元素的质量分数为66.7%
D.三聚氰胺的相对分子质量为126g难度: 中等查看答案及解析
-
下列说法正确的是( )
A.合金、合成材料、合成橡胶等都是重要的有机合成材料
B.“白色污染”是指白色塑料袋造成的污染
C.用甲醛浸泡水产品以达到保鲜的目的
D.化学反应是人类获取能量的重要方式难度: 中等查看答案及解析
-
下列实验现象或操作合理的是( )
A.镁带在空气中燃烧,生成黑色固体
B.硫在空气中燃烧生成二氧化硫
C.用托盘天平称取5.32g食盐
D.用高锰酸钾制取氧气,收集好气体后,应先将导管移出水槽再停止加热难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.3个钠离子--3
B.1个氧分子--O2
C.2个氮原子--N2
D.硫酸铁--FeSO4难度: 中等查看答案及解析
-
如图是某化学反应的微观示意图,其中不同的圆球代表不同原子.下列说法中正确的是( )
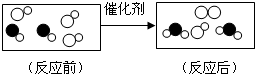
A.该反应涉及到四种原子
B.该反应属于置换反应
C.参加反应的两种分子的个数比为1:1
D.该反应前后所有元素的化合价都没有变化难度: 中等查看答案及解析
-
右图是三种微粒的结构示意图,有关它们的说法正确的是( )

A.它们的最外层电子数相同
B.它们的核外都有两个电子层
C.它们属于同种元素的微粒
D.它们都是原子难度: 中等查看答案及解析



