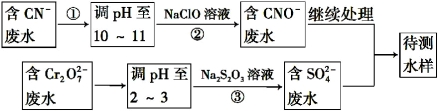
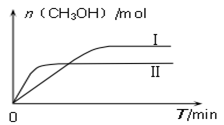
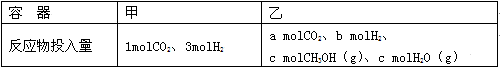
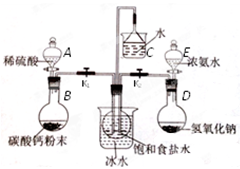
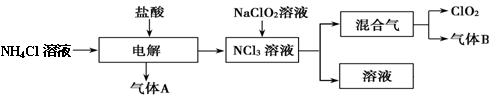
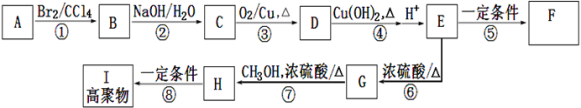
-
下列说
法正确的是
A.含有食品添加剂的物质均对人体健康有害
B.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl
D.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
难度: 简单查看答案及解析
-
常温下,某溶液中由水电离产生的c(OH-)、c(H+)满足c(OH-)·c(H+)=10-24,下列各组离子在溶液中可能大量共存的是
A.Mg2+、NO3-、K+、Cl- B.Fe2+ 、NO3-、Al3+ 、Cl-
C.Mg2+ 、SO42-、Na+ 、HCO3- D.K+、NH4+、AlO2-、SO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
B.为增强氯水的漂白性,可以向其中加入碳酸钙
C.NaH与重水反应的方程式:NaH+D2O==NaOH+D2↑
D.均含有NA个电子的H2O和CH4具有相同的体积
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.元素C、D的最高价氧化物对应的水化物之间不能发生反应
C.化合物AE与CE有相同类型的化学键
D.工业上常用电解法制备元素C、D、E的单质
难度: 困难查看答案及解析
-
农艺师对盆栽施用S-诱抗素剂(分子结构如下图),可以使鲜花按时盛开。下列说法不正确的是
A.S-诱抗素的分子式为C15 H20 O4
B.S-诱抗素既能发生加聚反应,又能发生缩聚反应
C.1 mol S-诱抗素最多能和含1 mol NaOH的水溶液发生反应
D.S-诱抗素既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
用4种溶液进行实验,表中“操作及现象”与“溶液”对应关系错误的是

难度: 中等查看答案及解析
-
下列各示意图与对应的表述不正确的是
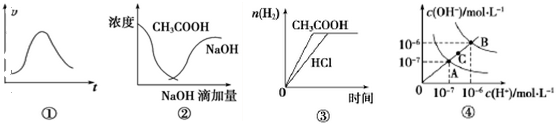
A.图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图
B.图②中
曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图
C.图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化
D.图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法
难度: 中等查看答案及解析