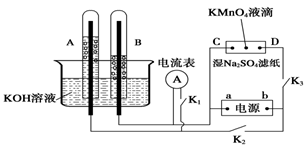
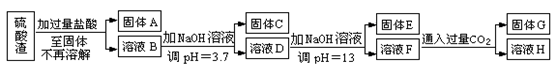
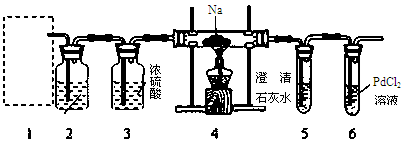
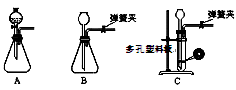-
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信所使用的光缆的主要成分是晶体Si,太阳能电池使用的常用材料主要是SiO2
B.我国重点城市近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
C.太阳光透过树叶间的缝隙射入密林中的光柱的形成属于丁达尔效应
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
难度: 中等查看答案及解析
-
下列有关化学实验的叙述中,正确的是
A.实验室氢氧化钠溶液应保存在带橡胶塞的试剂瓶中
B.做钠盐溶液的焰色反应时,用玻璃棒蘸取待测液放在酒精灯火焰上灼烧
C.中和滴定实验中用待测液润洗锥形瓶
D.向试管中滴加液体时,胶头滴管紧贴试管内壁
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.NaHCO3溶液中的水【解析】
HCO3-+H2OH3O++CO32-
B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+
C.CaCl2 溶液中通入CO2: Ca2++CO2+H2O=CaCO3↓+2H+
D.NaHSO4溶液中逐滴加入Ba(OH)2溶液至恰好呈中性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1 NA
B.100ml 18.4mol/L的浓硫酸与足量铜加热充分反应后生成SO2的数目为0.92 NA
C.密闭容器中盛有0.1molN2和0.3molH2,充分反应后转移电子的数目为0.6NA
D.80 g NH4NO 3晶体中含有NH4+ 数目为NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法不正确的是
X
A
Y
C
B
A.原子半径由小到大的顺序为:A<B<C<Y
B.A、B的氢化物的沸点由低到高的顺序为:HA<HB
C.X、Y最高价氧化物对应的水化物的酸性由弱到强的顺序为:H2YO3<H2XO3
D.B、C简单离子的还原性由弱到强的顺序为:B-<C2-
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A.将0.2 mol/L的某一元弱酸HA溶液和0.1 mol/LNaOH溶液等体积混合,则充分反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH相等的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液和NaOH溶液,其物质的量浓度由小到大的顺序为:c (NaOH)<c(CH3COONa)<c (NaHCO3)<c (C6H5ONa)
C.常温下,将pH=2.0的CH3COOH溶液和pH=12.0的NaOH溶液等体积混合,则充分反应后的混合液中:c (Na+)>c (CH3COO-)>c(OH-)>c (H+)
D.常温下,向10mL pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)、c(OH-)、c (CH3COOH)/c (CH3COO-)都将要变小
难度: 困难查看答案及解析
-
一定质量的镁、铝合金与硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2mol/L NaOH溶液至沉淀最多时停止加入,将所产生沉淀滤出,向滤液加水稀释至500ml,此时所得溶液物质的量浓度为
A.0.5mol/L B.1mol/L C.1.2mol/L D.2mol/L
难度: 中等查看答案及解析