-
下列说法正确的是( )
A. 1mol N2 的质量是14g B. H2SO4的摩尔质量是98 g
C. H2O的摩尔质量是18 g /mol D. 1mol HCl的质量是36.5 g /mol
难度: 简单查看答案及解析
-
下列各组离子,能大量共存于同一溶液中的是( )
A. CO32-、H+、Na+、NO3- B. H+、Ag+、Cl-、SO42-
C. K+、Na+、OH-、NO3- D. Ba2+、Ca2+、SO42-、OH-
难度: 简单查看答案及解析
-
下列离子反应方程式中,正确的是( )
A. 铁与稀硫酸反应 Fe+2H+=== Fe3++H2↑
B. 二氧化碳与水反应 CO2+H2O=== 2H++CO32-
C. 碳酸钡与盐酸反应 CO32—+2H+=== H2O+CO2↑+Ba2+
D. 氢氧化钠溶液与硫酸铜溶液反应 2OH—+Cu2+=== Cu(OH)2↓
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4 L水与22.4 L氢气所含原子数均为2 NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A. 1:1 B. 2:3 C. 3:2 D. 1:6
难度: 简单查看答案及解析
-
赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的。这种物质是
A. 盐酸 B. 氢氟酸 C. 烧碱 D. 纯碱
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂和还原剂物质的量之比为1:8
B. 2H2S+SO2═3S↓+2H2O中,氧化产物和还原产物的物质的量之比为1:1
C. 3S+6KOH═2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2:1
D. 5NH4NO3═4N2+2HNO3+9H2O中,反应中发生氧化反应和发生还原反应的氮原子物质的量之比为5:3
难度: 困难查看答案及解析
-
当钠、钾等金属不慎着火时,可以用来灭火的是:( )
A. 水 B. 湿抹布 C. 沙子 D. 泡沫灭火剂
难度: 中等查看答案及解析
-
为了检验某FeCl2溶液是否变质,可向溶液中加入 ( )
A. 铁片 B. 石蕊溶液 C. NaOH溶液 D. KSCN溶液
难度: 中等查看答案及解析
-
下列有关物质的用途错误的是 ( )
A. 硅(做半导体材料) B. 二氧化硅(制电线)
C. 水玻璃(用作粘合剂) D. Al2O3(用作耐火材料)
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A. KClO3在反应中得到电子 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. 1mol KClO3参加反应有2mol电子转移
难度: 中等查看答案及解析
-
下列描述的一定是金属元素的是( )
A. 易失去电子的物质 B. 能与酸反应的物质
C. 原子的最外层只有一个电子的元素 D. 原子核内有11个质子的元素
难度: 简单查看答案及解析
-
下列有关Na2CO3和NaHCO3性质的比较中,正确的是 ( )
A. 等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B. 热稳定性Na2CO3<NaHCO3
C. 常温时水溶性Na2CO3<NaHCO3
D. 二者不能互相转化
难度: 中等查看答案及解析
-
鉴别下列反应只能用焰色反应的是( )
A. 碳酸钾和氯化钠 B. 氯化钾和碳酸钠
C. 氯化钠和氯化镁 D. 氯化钠和氯化钾
难度: 简单查看答案及解析
-
下列金属单质中,能从CuSO4溶液中置换出Cu来的是( )
A. 汞 B. 银 C. 钠 D. 铁
难度: 简单查看答案及解析
-
在我国,使用最早的合金是( )
A. 碳素钢 B. 青铜 C. 镁铝合金 D. 合金钢
难度: 中等查看答案及解析
-
根据下面两个化学方程式判断Fe2+、Cu2+、Fe3+氧化性由弱到强的顺序是( )
①2FeCl3 +Cu=2FeCl2 +CuCl2 ②CuCl2 +Fe=Cu+FeCl2
A. Cu2+<Fe2+<Fe3+ B. Fe3+<Cu2+<Fe2+
C. Fe2+<Fe3+<Cu2+ D. Fe2+<Cu2+<Fe3+
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 钠、铁均是银白色金属,熔点高,硬度大
B. 实验室中,通常将钠保存在四氯化碳中
C. 钠在空气中燃烧产生黄色火焰
D. 高温时,铁与水蒸气反应生成氧化铁与氢气
难度: 困难查看答案及解析
-
下列关于金属铝的叙述中,说法不正确的是( )
A. Al是地壳中含量最多的金属元素
B. Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C. 铝箔在空气中受热可以熔化,融化物滴落
D. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
难度: 中等查看答案及解析
-
将一块新切开的钠放在玻璃片上,可观察到发生的一系列的变化:表面迅速变暗→“出汗” →变成白色粉末,下列有关叙述正确的是( )
A. 表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠
B. “出汗” 是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成溶液
C. 最后生成的白色粉末主要成分是碳酸氢钠
D. 该过程的所有变化均为物理变化
难度: 中等查看答案及解析
-
甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系。甲不可能是( )

A. Mg B. Fe C. C D. Al
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是( )
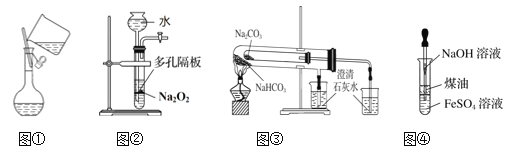
A. 图①向容量瓶中转移溶液
B. 图②用于Na2O2和H2O反应制取少量的O2
C. 图③比较碳酸钠和碳酸氢钠的热稳定性
D. 图④制备Fe(OH)2并能较长时间观察到白色
难度: 中等查看答案及解析
-
下列物质不能通过化合反应生成的是( )
A. NaOH B. Al(OH)3 C. FeCl2 D. FeCl3
难度: 中等查看答案及解析
-
将m克由CO和H2 组成的混合气体在足量的O2 中充分燃烧后,将生成的所有产物通过足量的Na2O2 固体,Na2O2 固体增加的质量为( )
A. 3/4m 克 B. m 克 C. 3/2m克 D. 4/3m克
难度: 困难查看答案及解析
-
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
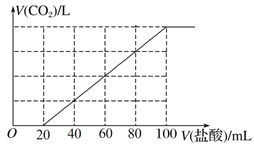
A. 通入CO2的物质的量为0.02 mol
B. 原NaOH溶液的浓度为0.12 mol·L-1
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=3∶1
难度: 困难查看答案及解析
