-
化学与环境、生活、科研息息相关,下列说法错误的是( )
A.双氧水稀溶液可用于清洗伤口
B. 14C可用于文物的年代鉴定,14C和12C互为同位素
C.PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
D.自来水厂可使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.氕、氘、氚核外电子排布相同,都可作为核聚变的材料
B.1 mol NH与23g Na+中含有的质子总数均为11×6.02×10 23
C.欲配制1.00 L 1.0 mol·L – 1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解1 mol熔融的AlCl3,理论上能产生33.6L氯气(标准状况)、27.0g铝
难度: 中等查看答案及解析
-
下列有关结构和性质的说法中,正确的是 ( )
A.Si、P、S、 Cl元素的单质与氢气化合越来越剧烈
B.元素原子的最外层电子数越多,元素的金属性越强
C.第三周期主族元素从左到右的最高价含氧酸酸性减弱
D.元素中期表共有18列,第8列属于第ⅧB族、第17列属于第ⅫA族
难度: 中等查看答案及解析
-
下列物质中能通过化合反应制取的是( )
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④FeCl3
A.①④ B.①②④ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
下列各组离子在碱性条件下能大量共存,在强酸性条件下能发生氧化还原反应的是( )
A.Mg2+、Na+、SO42-、Cl— B.K+、CO32-、Cl—、NO3—
C.NH4+、Na+、SO42-、NO3— D.Na+、K+、NO3—、SO32—
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.NH3通入AlC13溶液中
B.CO2通入到CaCl2溶液中
C.用脱脂棉包裹Na2O2粉末露置在潮湿空气中
D.稀盐酸滴加到Fe(OH)3胶体溶液中
难度: 中等查看答案及解析
-
下列有关化学实验叙述正确的是( )
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中
D.若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液
难度: 简单查看答案及解析
-
84消毒液的pH为10.2,可采用的适宜测定方法是 ( )
A.使用广泛pH试纸 B.使用精密pH试纸
C.使用pH计 D.以酚酞为指示剂进行酸碱中和滴定
难度: 中等查看答案及解析
-
下列关于元素周期表和元素周期律的说法正确的是( )
A.ⅥA族元素的原子半径越大,越容易得到电子
B.I A族与VIIA族元素间能形成离子化合物也能形成共价化合物
C.I A族元素的金属性比ⅡA族元素的金属性强
D.原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族
难度: 中等查看答案及解析
-
下列实验操作、现象及结论均正确的是( )
选项
实验操作
现象
结论
A
将SO2通入酸性KMnO4溶液中
紫色褪去
SO2具有漂白性
B
用容量瓶配制一定浓度的溶液,定容后摇匀
液面低于刻度线
溶液浓度偏高
C
将燃着的镁条伸入盛CO2的集气瓶中
镁条继续燃烧
镁有较强的还原性
D
将刚切开的钠块露置在空气中
表面变暗
钠表面生成Na2O2
难度: 中等查看答案及解析
-
利用下列装置进行相应实验,不能达到实验目的的是( )
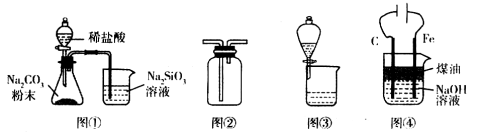
A.①装置可验证酸性:H2CO3>H2SiO3
B.图②装置可用于收集气体H2、CO2、Cl2、NH3
C.图③装置可用于分离互不相溶的两种液体
D.图④装置可制备Fe(OH)2并能较长时间保持其颜色
难度: 中等查看答案及解析
-
四种短周期元素在元素周期表中的相对位置如图所示,其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是( )
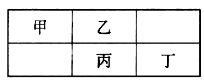
A.四种元素的单质中,丙单质的熔、沸点最高
B.丁元素氧化物对应水化物的酸性一定强于丙
C.乙元素形成的单核阴离子还原性强于丙
D.丁元素单质在化学反应中只表现氧化性
难度: 中等查看答案及解析
-
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于
Y的说法错误的是( )
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.
Y和
Y 是两种不同的核素
难度: 简单查看答案及解析
-
下表中的事实与推论不符的是( )
序号
事实
推论
A
与冷水反应,Na比Mg剧烈
金属性:Na>Mg
B
Ca(OH)2的碱性强于Mg(OH)2
金属性:Ca>Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S>C
D
HCl热稳定性比H2S强
非金属性:Cl>S
难度: 中等查看答案及解析
-
C、N、S是重要的非金属元素,下列说法正确的是( )
A.实验室用铜和浓硝酸反应制取NO
B.三种元素均可以和氧元素形成多种氧化物
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.稀硫酸、稀硝酸与铁的反应均属于置换反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c( H+)= 1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42-
B.能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl-
C.
=lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3-
D.能与铝反应放出H2的溶液中:Fe2+、K+、SO42-、Cl-
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.原子半径由小到大的顺序为Y<Z<X<W
B.X的简单氢化物的热稳定性比W的强
C.化合物YX、ZX2、WX3,中化学键的类型相同
D.W的最高价氧化物对应水化物的酸性比Z的弱
难度: 中等查看答案及解析
-
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如下图所示,则下列说法错误的是( )
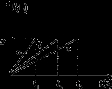
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图像
难度: 困难查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。用湿润的淀粉碘化钾试纸检验气体时,试纸先变蓝后褪色。下列有关说法正确的是( )
A.由反应可确定:氧化性HClO4 >HClO3
B.该反应的还原产物是O2和HClO4
C、试纸先变蓝后褪色是因为Cl2具漂白性
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
难度: 困难查看答案及解析
-
下列实验装置不能达到实验目的的是( )
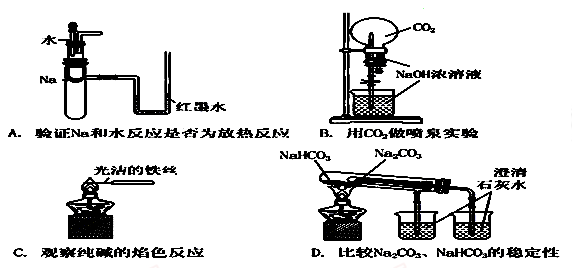
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子
C.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.用石墨作电极电解氯化镁溶液:2H2O+2Cl-
H2↑+Cl2↑+2OH-
B.用过量氨水吸收工业尾气中的SO2:2NH3·H20+SO2
2NH4++SO32-+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-
3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-
2BaSO4↓+Al(OH)3↓
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )
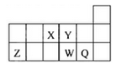
A.离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B.若存在简单阴离子R2-,则R不一定与Y、W同主族
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
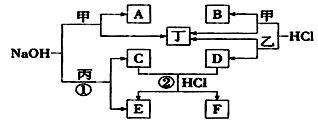
单质或化合物A可能为Na、C 、Si、 N2 、H2S,可以实现下列转化关系的有( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.标准状况下,2.24LCl2溶于水,转移6.02×1022个电子
B.Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O
C.NH4HCO3溶液中滴加少量NaOH溶液的离子方程式:HCO3-+OH-=CO32-+H2O
D.在PH=1的溶液中:K+、Fe2+、Cl-、NO3-能够大量共存
难度: 中等查看答案及解析