-
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
难度: 简单查看答案及解析
-
下列仪器常用于物质分离的是 ( )

A.①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
难度: 简单查看答案及解析
-
进行化学实验必须注意安全,下列说法正确的是( )
A.不慎将酸溅到眼中,应立即用干布擦,后边洗边眨眼睛。
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液。
C.酒精在实验台上燃烧时,用水扑灭火焰。
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸。
难度: 简单查看答案及解析
-
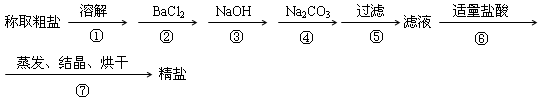
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤;正确的操作顺序是:( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
难度: 简单查看答案及解析
-
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀
B.形成的沉淀纯度更高
C.排除SO42-以外的其它阴离子及Ag+的干扰
D.排除Ba2+以外的其它阳离子的干扰
难度: 简单查看答案及解析
-
同质量的下列气体中,所含原子数最少的是 ( )
A.CH4 B.CO2 C.H2S D.N2
难度: 简单查看答案及解析
-
与50 mL 0.1 mol·L-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )
A.50mL 0.2mol·L-1 的 NaCl 溶液 B.100mL 0.1mol·L-1 的 NaCl 溶液
C.25mL 0.2mol·L-1 的 Na2SO4 溶液 D.10mL 0.5mol·L-1 的 Na2CO3 溶液
难度: 简单查看答案及解析
-
所含分子数相同的一组物质是:( )
A.1g H2和1g N2 B. 1mol H2O和1g H2O
C.3.2g O2和2.24L的空气(标准状况下) D. 44gCO2和6.02×1022个O2
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
难度: 简单查看答案及解析
-
标准状况下,mg气体A与ng气体B分子数相同,下列说法中不正确的是( )
A.气体A与B的相对分子质量比为 m:n
B.同质量气体A与B的分子个数比为 n:m
C.同温同压下,同体积A气体与B气体的密度比为 n:m
D.相同状况下,同体积A气体与B气体质量比为 m:n
难度: 简单查看答案及解析
-
在标准状况下,称量一个充满氯气的容器质量为74.6克,若改充氮气,其质量为66克,则容器的容积为 ( )
A. 11.2L B. 5.6L C. 4.48L D. 2.24L
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.1 mol H2O的质量是18 g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量是32 g
D.标准状况下,1 mol任何物质体积均为22.4 L
难度: 简单查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
难度: 简单查看答案及解析
-
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.16 g B.32 g C.64 g/mol D.32 g /mol
难度: 简单查看答案及解析
-
欲配制100 mL 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4溶于100 mL水中
②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL
③将20 mL5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①② B.②③ C.①③ D.①②③
难度: 简单查看答案及解析
-
已知1 g N2含有m个原子,则阿伏加德罗常数为( )
A.
B.14m mol-1 C.28m D.28m mol-1
难度: 简单查看答案及解析