-
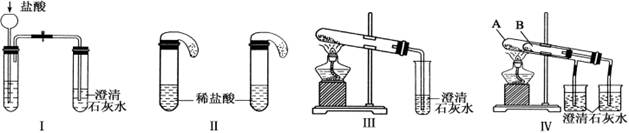
下列有关金属的说法正确的是
A.金属单质在常温下都是固体 B.金属原子只有还原性,金属阳离子只有氧化性
C.含金属元素的离子都是阳离子 D.金属阳离子被还原不一定生成金属单质
难度: 中等查看答案及解析
-
下列不能达到实验目的是
A B C D
A.比较苏打和小苏打的热稳定性 B.检查装置的气密性
C.向容量瓶中转移溶液 D.证明氨气极易溶于水
难度: 中等查看答案及解析
-
某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是
A.Fe2+、Cl-、Na+、NO3- B.K+、Na+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、NO3- D.Na+、K+、AlO2-、SO42-
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓
C.饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2 =2HCO3-
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
下列条件下,两种气体的分子数一定不相等的是( )
A.相同质量、不同密度的N2和C2H4
B.相同体积、相同密度的CO和C2H4
C.相同温度、相同压强、相同体积的O2和N2
D.相同压强、相同体积、相同质量的O2和N2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到金属的单质
C.能与酸反应的氧化物,不一定是碱性氧化物
D.电离时能生成H+的化合物一定是酸
难度: 简单查看答案及解析
-
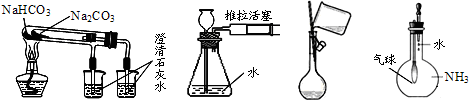
下列说法正确的是
A.用澄清石灰水可区别Na2CO3和NaHCO3粉末
B.只能用加试剂的方法区别(NH4)2SO4和Fe2(SO4)3溶液
C.用氯化钡溶液可区别SO42—和CO32—离子
D.用丁达尔效应可区别Fe(OH)3胶体和FeCl3溶液
难度: 简单查看答案及解析
-
为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2 mL试样于试管中,而后进行如下实验,其中不能达到目的的是:
A.加入过量稀硫酸,观察现象 B.加入澄清石灰水,观察现象
C.加入氯化钡溶液,观察现象 D.通适量CO2气体,观察现象
难度: 中等查看答案及解析
-
将含1mol HCl的稀盐酸,逐滴加入含0.2 mol NaOH和0.5 molNa2CO3的混合溶液中,充分反应后溶液中各物质的量是
HCl/mol NaCl/mol NaOH/mol Na2CO3/mol NaHCO3/mol
A 0 1 0.1 0 0.1
B 0 1 0 0.1 0.1
C 0.2 0.8 0 0 0.2
D 0 1 0 0 0.2
难度: 中等查看答案及解析
-
有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1 AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是
A.现象相同,沉淀量相等 B.现象不同,沉淀量不等
C.现象相同,沉淀量不等 D.现象不同,沉淀量相等
难度: 中等查看答案及解析
-
1 mol Na2O2与2 mol NaHCO3固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2、Na2CO3 C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3
难度: 中等查看答案及解析
-
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的液度为
A.0.5 mol/L B.1.0 mol/L C.2.0 mol/L D.3.0 mol/L
难度: 中等查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
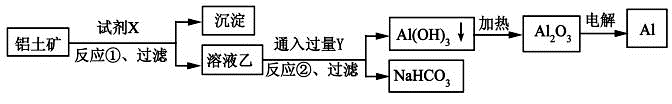
下列叙述正确的是
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2 + CO2 + 2H2O=Al(OH)3↓ + NaHCO3
难度: 中等查看答案及解析
-
一定体积CO2和O2的混合气体通过足量的Na2O2后,所得气体体积变为原来的3/4,则CO2在原混合气体中的体积分数为 ( )
A.25% B.40% C.50% D.75%
难度: 中等查看答案及解析
-
过氧化氢水溶液俗称双氧水,过氧化氢易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业常将H2O2转化为过碳酸钠晶体(其化学式为2Na2CO3.3H2O2),它具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是
A.MnO2 B.H2S C.稀盐酸 D.NaHCO3
难度: 中等查看答案及解析
-
将15.6g Na2O2和5.4g Al同时放入一定量的水中充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.最终得到7.8g的沉淀 B.反应过程中得到6.72L(标准状况)的气体
C.最终得到的溶液中c(NaCl)=2.0mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
难度: 中等查看答案及解析
-
现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案
实验设计1:铝镁合金
测定生成的气体在标准状况下的体积
实验设计2:铝镁合金
测定生成的气体在标准状况下的体积
实验设计3:铝镁合金
溶液
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是( )
A.都能 B.都不能
C.①不能,其它都能 D.②③不能,①能
难度: 中等查看答案及解析
-
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
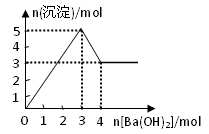
A.MgSO4 B.KAl(SO4)2 C.Al2(SO4)3 D.NaAlO2
难度: 简单查看答案及解析
-
120mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol/L B.0.18 mol/L C.1.5 mol/L D.0.24 mol/L
难度: 中等查看答案及解析
-
体积为VmL,密度为dg/mL,溶质的摩尔质量为Mg·mol-1,物质的量浓度为cmol·L-1,溶质的质量分数为a%,溶质的质量为mg。下列式子正确的是( )
A.m=aV/100d B.c=
C.c=
D.a%=
%
难度: 中等查看答案及解析
-
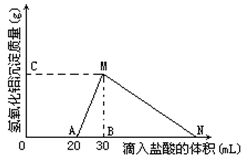
某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是( )
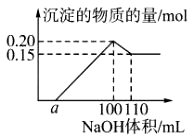
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
难度: 中等查看答案及解析
-
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是( )
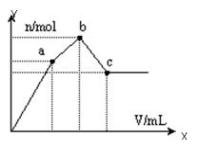
A.a点对应的沉淀只有BaSO4
B.c点溶液呈碱性
C.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓
D.c点加入Ba(OH)2溶液的体积为200 mL
难度: 困难查看答案及解析