-
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同难度: 中等查看答案及解析
-
根据元素的原子序数,可推知原子的是( )
①质子数②中子数③质量数④核电荷数⑤核外电子数.
A.①②③
B.①④⑤
C.②③④
D.③①⑤难度: 中等查看答案及解析
-
氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的熔、沸点依次升高
B.单质与氢气反应越来越难
C.Cl2可从KI溶液中置换出I2
D.F2可从NaCl溶液中置换出Cl2难度: 中等查看答案及解析
-
已知钡的金属活动性处于钾和钠之间.下列反应可以实现的是( )
A.钡可以从氯化钾溶液中置换出钾
B.钡可以从氯化钠溶液中置换出钠
C.钡可以从冷水中置换出氢而得到氢气
D.在溶液中钡离子可以氧化金属锌难度: 中等查看答案及解析
-
在元素周期表的前四周期中,如图排列着五种元素.若B元素的核电荷数为Z,则这5种元素的核电荷数之和可能为( )
A.5Z+2
B.5Z+10
C.5Z+8
D.5Z+18难度: 中等查看答案及解析
-
下列各组中属于同位素关系的是( )
A.与
B.T2O与H2O
C.与
D.金刚石与石墨难度: 中等查看答案及解析
-
元素的性质呈周期性变化的根本原因是( )
A.元素的相对原子质量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化难度: 中等查看答案及解析
-
下列微粒半径比大于1的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.若1molRO3-参与该反应,则转移的电子的物质的量为5mol难度: 中等查看答案及解析
-
下列各组物质中,化学键类型不同的是( )
A.CCl4和SO2
B.H2O和NH3
C.CaF2和CsCl
D.NaCl和HNO3难度: 中等查看答案及解析
-
已知R2+离子有b个中子,核外有a个电子.表示R原子符合正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
同族元素所形成的同一类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
A.它是一种共价化合物
B.在加热时此化合物可以分解为PH3和HI
C.这种化合物不能跟碱反应
D.该化合物可以由PH3和HI化合而成难度: 中等查看答案及解析
-
下列各组性质的比较中正确的是( )
①酸性:HClO4>HBrO4>HIO4;②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2;
③稳定性:HCl>PH3>H2S;④还原性:Cl-<Br-<I-.
A.都正确
B.①②③
C.①②
D.①②④难度: 中等查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,破坏1molH2中的化学键消耗的能量为Q1kJ,破坏1molCl2中的化学键消耗的能量为Q2kJ,形成1molHCl中的化学键释放的能量为Q3kJ.下列关系式中,正确的是( )
A.Q1+Q2>Q3
B.Q1+Q2>2Q3
C.Q1+Q2<Q3
D.Q1+Q2<2Q3难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.原电池的负极得到电子,发生还原反应
B.原电池中较活泼的金属作正极
C.原电池中的电极一定要由两种不同的金属组成
D.原电池中发生氧化反应的电极是负极难度: 中等查看答案及解析
-
如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
选 项 M N P A 锌 铜 稀硫酸 B 铜 铁 稀盐酸 C 银 锌 硝酸银溶液 D 锌 铁 硝酸铁溶液 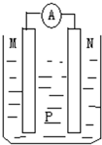
A.A
B.B
C.C
D.D难度: 中等查看答案及解析