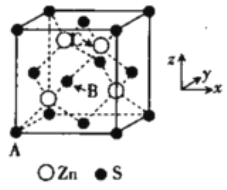
-
化学与生活、社会密切相关,下列说法正确的是( )
A. 高锰酸钾溶液、酒精、双氧水能杀菌消毒,都利用了强氧化性
B. 将矿物燃料脱硫脱硝可有效防止酸雨
C. 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
D. 以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
难度: 中等查看答案及解析
-
家用液化气的主要成分为丙烷、丙烯、丁烷和丁烯,下列说法不正确的是( )
A. 丙烯和丁烯均能发生加成反应 B. 可用溴水来鉴别丙烷与丙烯
C. 丁烷中所有原子不可能处于同一平面 D. 丙烷的二氯代物有3种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 1 mol羟基中含有l0NA个电子
B. 常温下,22.4 L CH4在O2中完全燃烧,生成NA个CO2分子
C. 标准状况下,18 g H2O中所含的氧原子数为NA
D. 0.2 mol • L-1的NH4Cl溶液中含有0.2NA个NH4+
难度: 中等查看答案及解析
-
锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物, 电解质是熔融薄膜状的碘化锂,正极的电极反应式为P2VP·nI2+2Li++2e-= P2VP·(n-1)I2+2LiI。下列说法正确的是( )
A. 该电池放电时,锂电极发生还原反应
B. P2VP和I2的复合物是绝缘体,不能导电
C. 电池工作时,碘离子移向Li电极
D. 该电池发生的总反应为2Li+P2VP·nI2= P2VP·(n-1)I2+2LiI
难度: 困难查看答案及解析
-
a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是( )
A. d的氧化物对应的水化物酸性均比b的强
B. a、b、d 三种元素形成的化合物可能既含离子健又含共价键
C. 原子半径:c>d>a
D. 单质的熔点:c>b>a
难度: 困难查看答案及解析
-
下列根据实验操作和实验现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
向盛有硅酸钠溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
试管中有凝胶生成
非金属性:Cl>Si
B
向CuSO4溶液中加入KI溶液,再加入苯,振荡
有白色沉淀生成,苯层显紫红色
白色沉淀可能为CuI
C
常温下,向pH=2.0的FeCl3溶液中通入H2S气体,再用pH计测量溶液的pH
产生淡黄色沉淀,溶液pH=1.0
酸性:H2S>HCl
D
向久置的Na2O2中加入足量的盐酸
产生无色气体
Na2O2已变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=[
]×100%]。
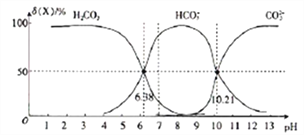
下列说法错误的是( )
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
C. pH=13时,c(Na+)+c(H+)=c(OH-)+2c(CO32-)
D. 25℃时,反应CO32-+H2O
HCO3-+OH-的平衡常数对数值1gK=-3.79
难度: 困难查看答案及解析
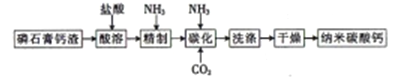
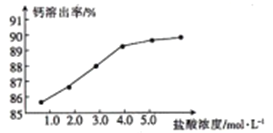

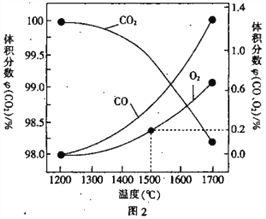

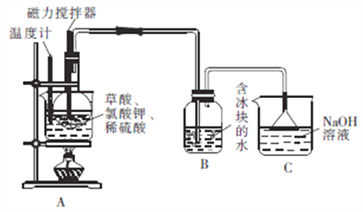
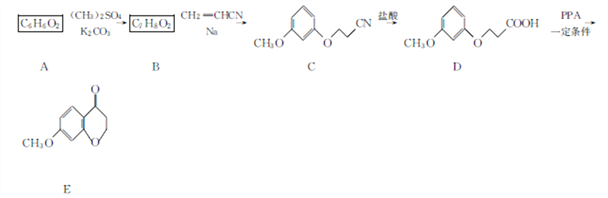
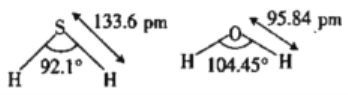
 )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。