-
由锌.铁.铝.镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是( )
A.锌
B.铁
C.铝
D.镁难度: 中等查看答案及解析
-
在5mL 0.1mol/L KI溶液中滴加0.1mol/L FeCl3溶液5~6滴后,生成Fe2+和I2,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色难度: 中等查看答案及解析
-
在物质分类中,前者包含后者的是( )
A.氧化物、化合物
B.化合物、电解质
C.溶液、胶体
D.非金属氧化物、酸性氧化物难度: 中等查看答案及解析
-
下列有关阿伏加德罗常数正确的是( )
A.1mol/L醋酸溶液中离子总数小于2NA
B.标准状况下,22.4LSO3所含的分子数为NA
C.46 g NO2 和 N2O4混合气体中含有原子数为3NA
D.300ml 2mol/L蔗糖溶液中所含分子数为0.6 NA难度: 中等查看答案及解析
-
工业上将氨气和空气的混合气体通过铂-铑合金网发生氮氧化反应,若有标准状况下yL氨气完全反应,并转移n个电子,则阿伏加德罗常数NA可表示为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
同温同压下,在两个体积相同密闭容器中分别充入甲、乙两种气体,若甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的气体摩尔体积比乙的气体摩尔体积小
D.甲的相对分子质量比乙的相对分子质量大难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O
B.向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O
D.钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+难度: 中等查看答案及解析
-
下列各组离子,在所给条件下一定能大量共存的是( )
A.在含有SO42-的溶液中Fe3+、Ba2+、Ⅰ-、Cl-
B.水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-、CO32-、NH4+
C.pH=0的溶液中,Fe3+、Mg2+、SO42-、Cl-
D.加入铝粉放出氢气的溶液中:NO3-、Cl-、NH4+、Mg2+难度: 中等查看答案及解析
-
元素的性质包含金属性和非金属性,其强弱可以通过该元素对应的某些化学性质体现出来.某同学认为铝元素是金属元素,但是有一定的非金属性.下列化学反应中,你认为能支持该同学观点的是( )
A.铝片与盐酸反应生成氢气
B.氢氧化铝溶于强碱溶液
C.氢氧化铝溶于强酸溶液
D.铝热反应难度: 中等查看答案及解析
-
用试纸检验气体性质是一种重要的实验方法.如图所示,下列试纸选用、现象、对比结论都正确的一项是( )
选项 试剂B 湿润的试纸A 现象 结论 A. 碘水 淀粉试纸 变蓝 碘具有氧化性 B. 浓氨水、生石灰 蓝色石蕊试纸 变红 氨气为碱性气体 C. Na2SO3、硫酸 品红试纸 褪色 SO2具有漂白性 D. Cu,浓硝酸 KI-淀粉试纸 变蓝 NO2为酸性气体
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+Sn2++2Fe3+=2Fe2++Sn4+由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe3+、Sn2+、Ce3+难度: 中等查看答案及解析
-
下列物质的保存方法正确的是( )
①少量金属钠保存在冷水中 ②浓硝酸盛放在无色试剂瓶中
③少量金属钾保存在煤油中 ④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡胶塞的细口瓶中
⑦盛溴的试剂瓶里加一些水来防止溴挥发.
A.③④⑤
B.③④⑥⑦
C.③④⑦
D.③④⑤⑦难度: 中等查看答案及解析
-
实验室里需用480mL 0.1mol/L的硫酸铜溶液,现选取进行配制,以下操作正确的是( )
A.480 mL容量瓶,称取7.68 g硫酸铜,加入500 mL水
B.500 mL容量瓶,称取12.0 g胆矾配成500 mL溶液
C.480 mL容量瓶,称取8.0 g硫酸铜,加入500 mL水
D.500 mL容量瓶,称取12.5 g胆矾配成500 mL溶液难度: 中等查看答案及解析
-
在100mL 0.2mol/LHBr和0.1mol/L的H2SO3的溶液里通入0.01mol Cl2,反应后溶液的体积没有变化,下列说法正确的是( )
A.反应的溶液中H2SO3浓度仍为0.1mol/L
B.反应的溶液中HBr浓度仍为0.2mol/L
C.反应的溶液中Cl-浓度为0.1mol/L
D.反应溶液中H+浓度没有变化难度: 中等查看答案及解析
-
某中学一实验小组组装了下列所示实验装置,其中能达到实验目的是( )
A.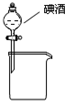
分离碘酒中的碘和酒精
B.
实验室制氨气
C.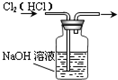
除去Cl2中的HCl
D.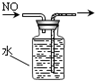
排出集气法收集NO难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X.它们有如图所示的转化关系(部分产物及反应条件已略去):下列说法中不正确的是( )
A.X元素可能为Al
B.X元素一定为非金属元素
C.A可能是Cl2
D.反应①和②一定为氧化还原反应难度: 中等查看答案及解析