-
下列变化不需要破坏化学键的是( )
A. 加热氯化铵 B. 冰融化成水
C. 水通电分解 D. 氯化氢溶于水
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 糖类化合物也可称为碳水化合物
B. 维生素D可促进人体对钙的吸收
C. 蛋白质是仅由碳、氢、氧元素组成的物质
D. 硒是人体必需的微量元素,但不宜摄入过多
难度: 中等查看答案及解析
-
a、b、c、d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数与 b 原子次外层的电子数相同;c 所在周期数与族数相同;d 与 a 同族,下列叙述正确的是
A. 原子半径:d>c>b>a B. 4 种元素中 b 的金属性最强
C. c 的氧化物的水化物是强碱 D. d 单质的氧化性比 a 单质的氧化性强
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是( )
实 验
结 论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2﹣二溴乙烷无色、可溶于四氯化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的一氯甲烷具有酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
水资源非常重要,海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是( )
A. 过滤法 B. 蒸馏法 C. 分液法 D. 萃取法
难度: 简单查看答案及解析
-
下列试剂中,能用于检验酒精中是否含有水的是( )
A. CuSO4·5H2O B. 浓硫酸 C. 无水硫酸铜 D. 金属钠
难度: 中等查看答案及解析
-
下列微粒中与OH-离子具有相同的质子数和相同的电子数,该微粒可能为
A. F- B. Mg2+ C. NH4+ D. CH4
难度: 中等查看答案及解析
-
1mol丙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气为
A. 5mol B. 6mol C. 7mol D. 8mol
难度: 中等查看答案及解析
-
用锌粒与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A. 升高反应体系的温度 B. 增加锌粒的用量
C. 不用锌粒,改用锌粉 D. 滴入少量硫酸铜溶液
难度: 中等查看答案及解析
-
下列化学式只代表一种物质分子的是( )
A. CH2Cl2 B. C2H4Cl2 C. C4H10 D. C5H12
难度: 中等查看答案及解析
-
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是
A. 非金属性A>B>C B. 气态氢化物稳定性HA>H2B>CH3
C. 原子半径A>B>C D. 阴离子还原性C3->B2->A-
难度: 中等查看答案及解析
-
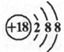
下列化学用语或模型正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 乙醇的化学式:C2H5OH
C. 钙离子的结构示意图:
 D. CH4分子的比例模型
D. CH4分子的比例模型
难度: 中等查看答案及解析
-
以下装置能形成原电池的是( )
A.
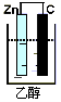 B.
B. 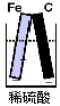 C.
C. 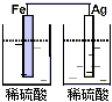 D.
D. 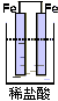
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率 最快的是 ( )。
A. v(D)=0.4 mol·(L·s)-1 B. v(A)=0.15 mol·(L·s)-1
C. v(B)=0.6 mol·(L·s)-1 D. v(C)=0.5 mol·(L·s)-1
难度: 中等查看答案及解析
-
下列反应,光照对反应几乎没有影响的是( )
A. 氯气和氢气的反应 B. 甲烷和氧气的反应
C. 氯气与甲烷的反应 D. 次氯酸的分解
难度: 中等查看答案及解析
-
下列各组液体混合物,能用分液漏斗分离的是:( )
A. 溴苯和溴 B. 苯和硝基苯 C. 正己烷和水 D. 乙醇和水
难度: 中等查看答案及解析
-
某有机物的结构简式为HO-CH2CH=CHCH2-COOH,该有机物不可能发生的化学反应是( )
A. 水解 B. 酯化 C. 加成 D. 氧化
难度: 中等查看答案及解析
-
某实验兴趣小组以Zn和Cu为电极,稀硫酸为电解质溶液研究原电池,并对实验进行了拓展,以下实验记录错误的是( )
A. 铜片上有气泡产生,锌片逐渐溶解
B. 电子在溶液中从Zn电极流向Cu电极
C. 把锌片换成石墨,电流计指针没有明显偏转
D. 把稀硫酸换成硫酸铜溶液,电流计指针依然偏转
难度: 中等查看答案及解析
-
已知
(石墨) =
(金刚石),在该反应进程中其能量变化如图所示,有关该反应的描述正确的是( )
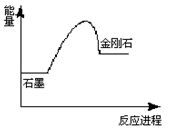
A. 该反应为放热反应
B. 金刚石比石墨稳定
C. 该反应为氧化还原反应
D. 石墨比金刚石稳定
难度: 中等查看答案及解析
-
一定质量的某有机物和足量的金属钠反应,可得到气体V1L,等质量的该有机物与足量的纯碱反应,可得到气体V2L。若同温同压下V1>V2(V2不为零),则该有机物可能是( )
A. HOCH2CH2COOH B. HOOC-COOH C. HOCH2CH2OH D. CH3COOH
难度: 困难查看答案及解析

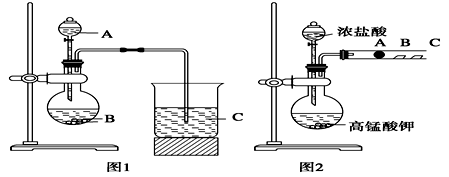
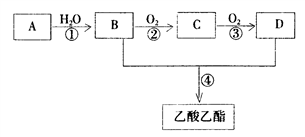
 。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。