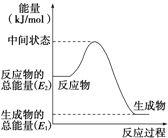
-
下列属于直接利用太阳辐射能的是( )
①光-热转换 ②光-电转换 ③光—化学能转换 ④光-生物质能转换
A. ①②③ B. ①③④ C. ①②④ D. ①②③④
难度: 简单查看答案及解析
-
能源可分为一次能源和二次能源。直接从自然界取得的能源称为一级能源;一级能源经过加工、转换得到的能源称为二次能源。下列属于二次能源的是 ( )
A. 水力 B. 电能
C. 化石燃料 D. 地热能
难度: 简单查看答案及解析
-
下列关于反应与能量的说法正确的是
A. H2与Cl2反应生成HCl,在光照与点燃条件下,ΔH不同
B. 氢氧化钠与盐酸反应中,盐酸足量,则氢氧化钠越多,中和热越大
C. 已知1mol红磷转化为1mol白磷,需吸收18.39kJ的能量,则红磷比白磷稳定
D. 催化剂能加快反应速率,是因为它能减小反应的焓变
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的NaOH的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A. △H1>△H2>△H3 B. △H1<△H2<△H3
C. △H1>△H2=△H3 D. △H1<△H2=△H3
难度: 中等查看答案及解析
-
反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )
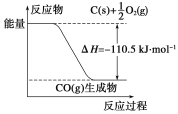
A、12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B、该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C、2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D、该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 由C(金刚石)===C(石墨) ΔH= -1.9 kJ·mol-1 可知,金刚石比石墨稳定
C. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=285.8 kJ·mol-1
D. 稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-53.7 kJ·mol-1 ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7 kJ
难度: 困难查看答案及解析
-
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态水,同时放出22.68kJ热量,下列表示该反应的热化学方程式的是( )
A. CH3OH(l)+
O2===CO2(g)+2H2O(l) △H =-725.8kJ/mol
B. 2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l) △H =+145.6kJ/mol
C. 2CH2OH(l)+3O2(g)====2CO2(g)+4H2O(l) △H =-22.68kJ/mol
D. CH3OH(l) +
O2(g)===CO2(g)+2H2O(g) △H =-725.8kJ/mol
难度: 中等查看答案及解析
-
下列有关实验操作的解释或结论正确的是
选项
实验操作
解释或结论
A
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
Fe(OH)3的溶解度小于Mg(OH)2的
B
用蒸馏水润湿的pH试纸测溶液的pH
一定会使测定结果偏低
C
测定中和热时,使用碎泡沫起隔热保温的作用,用普通玻璃棒进行搅拌使酸和碱充分反应,准确读取实验时的最高温度并且取2~3次的实验平均值等,以达到良好的实验效果
用简易量热计
测定反应热来
D
用氢氧化钾与浓硫酸测定中和反应的反应热
测得的结果偏小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定条件下,乙烷发生分解反应: C2H6
C2H4+ H2。一段时间后,各物质的浓度保持不变,这说明
A.反应完全停止
B.反应达到平衡状态
C.反应物消耗完全
D.正反应速率大于逆反应速率
难度: 简单查看答案及解析
-
把4molA和2.5molB混合于2L密闭容器中,发生反应:3A(g)+2B(s)
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
A. A的平均反应速率为0.15mol·L-1·min-1 B. 平衡时,C的浓度为0.25 mol·L-1
C. B的平均反应速率为0.1mol·L-1·min-1 D. 平衡时,容器内压强为原来的0.875倍
难度: 中等查看答案及解析
-
反应4NH3(g) + 5O2(g)
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
x
A.
(O2) = 0.01mol·(L·s) –1 B.
(NO) = 0.008mol·(L·s) –1
C.
(H2O) = 0.006mol·(L·s) –1 D.
(NH3) = 0.002mol·(L·s) –1
难度: 中等查看答案及解析
-
一定条件下,反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
难度: 中等查看答案及解析
-
下表中是各组反应的反应物和反应温度,反应刚开始时放出H2速率最快的是( )
编号
金属(粉末状)
酸的浓度及体积
反应温度
A
Mg,0.1 mol
6mol·L-1硝酸10mL
60℃
B
Mg,0.1 mol
3mol·L-1盐酸10mL
60℃
C
Fe,0.1 mol
3mol·L-1L盐酸10mL
60℃
D
Mg,0.1 mol
3mol·L-1硫酸10mL
60℃
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
500mL K2SO4和CuSO4的混合液中c(SO42-)= 3mol/L,用石墨电极电解此溶液,通电一段时间,两极上均产生22.4L(标准状况)气体,则原混合液中K+的浓度是( )
A. 0.5mol/L B. 4mol/L C. 1.5mol/L D. 2mol/L
难度: 中等查看答案及解析
-
如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )

A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
难度: 中等查看答案及解析
-
电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
难度: 困难查看答案及解析