-
用生石灰中和法阻止海水酸化是人们的一种设想。生石灰(CaO)属于
A.酸 B.碱 C.盐 D.氧化物
难度: 简单查看答案及解析
-
下列过程发生化学变化的是
A.花香四溢 B.海水晒盐 C.粮食酿酒 D.冰雪消融
难度: 简单查看答案及解析
-
下列物质中含有共价键的是
A.HCl B.NaCl C.MgO D.KI
难度: 简单查看答案及解析
-
下列各组物质互为同分异构体的是
A.O2和O3 B.CH3CH2CH2CH3和CH(CH3)3
C.12C和13C D.CH3和CH3CH3
难度: 简单查看答案及解析
-
某溶液中存在大量的H+、Cl一、SO42一,该溶液中还可能大量存在的是
A.HCO3一 B.Ba2+ C.Al3+ D.Ag+
难度: 简单查看答案及解析
-
下列物质含有离子键的是
A.C12 B.NaCl C.CO2 D.H2O
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.常温常压下,活泼金属与盐酸反应置换生成1摩H2,发生转移的电子数为1NA
B.22.4 L氢气中,一定含有2 mol氢原子
C.在常温常压下,28g CO和N2的混合气体中含有的分子数为1NA
D.80gNaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L
难度: 简单查看答案及解析
-
溶液、胶体和浊液这三种分散系的根本区别是
A.是否有丁达尔现象 B.分散质粒子的大小
C.能不能通过滤纸或半透膜 D.是否均一、稳定、透明
难度: 简单查看答案及解析
-
冶炼Na、Al等活泼金属通常采用的方法是
A.电解其熔融盐或氧化物 B.电解其盐的水溶液
C.热分解法 D.热还原法
难度: 简单查看答案及解析
-
现用胆矾(CuSO4•5H2O)配制0.1mol·L—1的硫酸铜溶液,下列操作中合理的是
A.称量时,将胆矾晶体直接放在托盘天平的右盘上
B.准确称取16.0g胆矾,溶于水,所得溶液恢复到室温,再转移至1000mL容量瓶中,定容
C.准确称取25.0g胆矾,溶于水,所得溶液恢复到室温,再转移至1000mL容量瓶中,定容
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
下列各组离子中,能在溶液中大量共存的是
A.H+ Na+ CO32- Cl- B.Mg2+ Na+ Cl- SO42-
C.K+ NH4+ SO42- OH- D.Fe2+ Al3+ Cl- H+
难度: 简单查看答案及解析
-
下列说法正确的是
A. 金属单质和酸反应一定放出氢气
B. 含金属元素的离子一定是阳离子
C. 金属阳离子被还原一定得到金属单质
D. 金属单质在化学反应中只作为还原剂失去电子
难度: 简单查看答案及解析
-
如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是

A.铜电极上的反应为Cu-2e-==Cu2+
B.锌电极上的反应为2H++2e-==H2↑
C.锌片是负极,铜片是正极
D.电子由铜片经导线流向锌片
难度: 简单查看答案及解析
-
在相同条件下,下列各组气体中,分子数一定相同的是
A.34g NH3和4g H2 B.28g N2和32g O2
C.2L CO2和2L H2O D.11.2L O2和0.5mol O2
难度: 简单查看答案及解析
-
接触法制硫酸,接触室中反应为:2SO2+O2
2SO3 。对该反应的有关说法错误的是
A.该反应是可逆反应 B.反应中SO2能全部转化为SO3
C.催化剂能加快该反应的速率 D.升高温度能加快该反应的速率
难度: 简单查看答案及解析
-
关于化学反应中的说法错误的是
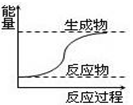
A.上图所示的反应为放热反应
B.化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应
D.化学键断裂吸收能量,化学键生成放出能量
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.氯化钠的电子式
B.乙炔的结构式H-C=C-H
C.磷原子的结构示意图
D.乙酸的分子式C2H4O2
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.钠和水反应2Na+2H2O=2Na++2OH-+H2↑
B.盐酸与氢氧化钠溶液反应H++OH-=H2O
C.三氯化铁腐蚀印刷线路板Fe3++Cu=Fe2++Cu2+
D.盐酸与碳酸钙反应制备二氧化碳CO32-+2H+=CO2↑+H2
难度: 简单查看答案及解析
-
A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.原子半径:C>A
B.气态氢化物的稳定性:A>B
C.最高价氧化物对应水化物的碱性:C < D
D.D元素形成的氧化物和氢氧化物能溶于酸,但不能溶于C元素形成的氢氧化物
难度: 简单查看答案及解析
-
标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
难度: 简单查看答案及解析