-
“环境问题”是当今全球共同关注的焦点,在哥本哈根气候大会上中国发挥了重要的作用。下列对环境造成危害的一组首要污染物是
A.CO2、SO2、O2 B.SO2、NO2、可吸入颗粒物
C.CO2、N2、O2 D.NO2、N2、可吸入颗粒物
难度: 简单查看答案及解析
-
某微粒的结构示意图为
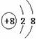 它表示
它表示A.钠离子 B.氧离子 C.氖原子 D.氧原子
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A.在标准状况下,NA个水分子所占的体积约为22.4L
B.5.6g铁与氯气完全反应,失去电子的数目为0.2NA
C.1L 0.3mol ·L-1Na2SO4溶液中,含有Na+和SO42- 总数为0. 6NA
D.常温常压下,32g O2所含氧原子数是2NA
难度: 中等查看答案及解析
-
下列物质属于离子化合物的是
A.H2O B.HCl C.MgCl2 D.SO2
难度: 中等查看答案及解析
-
碳的一种同位素146C可用于考古断代。下列关于146C说法正确的是
A.质子数为14 B.中子数为8 C.质量数为6 D.核外电子数为8
难度: 简单查看答案及解析
-
互为同素异形体的一组物质是
A.16 8O和18 8O
B.O2和O3
C.CH≡CH和CH2=CH2
D.CH3CH2CH2CH3和
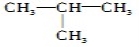
难度: 中等查看答案及解析
-
在水溶液中能大量共存的离子组是
A.Al3+ H+ HCO3- B.Na+ NO3- Cl-
C.H+ OH- SO42- D.Ca2+ K+ CO32-
难度: 中等查看答案及解析
-
构成下列四种物质的微粒间,既存在离子键又存在共价键的是
A.MgCl2 B.K2S C.NaOH D.SO3
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.氯化亚铁溶液和氯气反应:Fe2++Cl2=Fe3++2Cl-
B.大理石和盐酸反应:CO32-+2H+=CO2↑+H2O
C.碳酸氢钠溶液和稀硝酸反应:HCO3-+H+=H2↑+CO32-
D.盐酸和氢氧化钾溶液反应:H++OH-=H2O
难度: 中等查看答案及解析
-
以下物质保存方法不正确的是
A.少量金属钠保存在煤油中
B.FeSO4溶液存放在加有少量铁粉的试剂瓶中
C.浓硝酸保存在棕色试剂瓶中
D.氢氧化钠溶液保存在配有玻璃塞的细口瓶中
难度: 中等查看答案及解析
-
下列物质在一定条件下能够导电,但是不属于电解质的是
A.铝 B.食盐 C.硫酸 D.蔗糖
难度: 简单查看答案及解析
-
下列叙述错误的是
A.合金材料中可能含有非金属元素
B.光导纤维的主要成分是二氧化硅
C.金属氧化物均为碱性氧化物
D.不需要通过化学反应就能从海水中获得食盐和淡水
难度: 中等查看答案及解析
-
下列除去杂质的方法错误的是
A.除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶
B.除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤
C.除去Na2CO3固体中的NaHCO3:加热至恒重
D.除去CuO中混有的Al2O3:加过量盐酸后,过滤
难度: 中等查看答案及解析
-
在下列氧化还原反应中,水只作还原剂的是
A.Mg+2H2O=Mg(OH)2+H2 ↑
B.2H2O
2H2↑+ O2↑
C.2F2+ 2H2O = O2 +4HF
D.3NO2+ H2O = 2HNO3 + NO
难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
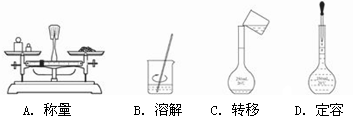
难度: 中等查看答案及解析
-
下列有关金属的工业制法中,错误的是
A.制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠
B.制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁
C.制硅:用焦炭还原二氧化硅得硅
D.制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁
难度: 中等查看答案及解析
-
铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法不正确的是
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何碱反应
C.铝元素在地壳中的含量高,储量丰富
D.工业上可以用电解法冶炼铝
难度: 简单查看答案及解析
-
对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.浓硝酸试剂瓶口常有白雾,说明浓硝酸有挥发性
难度: 中等查看答案及解析
-
下列物质的用途中,不正确的是
A.Na2O2作呼吸面具中的供氧剂
B.硫磺用于制火药
C.镁合金用于制造汽车、飞机、火箭
D.BaCO3作“钡餐”-检查肠胃的内服药
难度: 中等查看答案及解析
-
向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属阳离子是
A.Fe 2+、Cu2+ B.Fe 2+、Fe3+
C.Fe 3+、Cu2+ D.只有Cu2+
难度: 中等查看答案及解析
-
湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体中可能是①Cl2,②NO2,③CO2,④SO2,⑤HCl,⑥溴蒸气中的
A.①③④ B.①②⑤ C.②④⑤ D.①②⑥
难度: 中等查看答案及解析