-
下列古诗词描述的场景中发生的化学反应不属于氧化还原反应的是
A. 爆竹声中一岁除——黑火药受热爆炸
B. 烈火焚烧若等闲——石灰石分解
C. 蜡烛成灰泪始干——石蜡的燃烧
D. 炉火照天地,红星乱紫烟——铁的冶炼
难度: 简单查看答案及解析
-
装运金属钠的包装箱标签上应印有下列警示标记中的
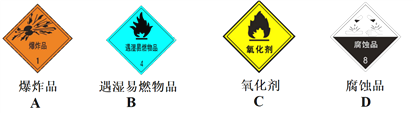
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于氯气和氯水的说法中正确的是
A. 氯气是一种无色、密度比空气大的有毒气体
B. 红热的铁丝在Cl2中剧烈燃烧生成FeCl2
C. 新制氯水能使有色布条褪色是因为Cl2有漂白性
D. 氯水放置数天后酸性增强
难度: 简单查看答案及解析
-
以下说法正确的是
A. 物质所含元素化合价升高的反应叫还原反应
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 还原剂中必定有一种元素被氧化
难度: 中等查看答案及解析
-
下列关于钠的叙述中,正确的是
A. 钠露置在空气中最终变为过氧化钠固体
B. 钠能从溶液中置换出金属活动顺序表中钠后面的金属
C. 钠蒸气充入灯泡中制成钠灯,常用于公路照明
D. 金属钠着火时,能用泡沫灭火器来灭火
难度: 简单查看答案及解析
-
下列事实与胶体性质无关的是
A. 向豆浆中加入石膏做豆腐
B. 利用丁达尔效应可以区别溶液与胶体
C. 将植物油倒入水中用力搅拌形成油水混合物
D. 可用FeCl3溶液作外伤止血剂
难度: 简单查看答案及解析
-
下列关于物质分类的组合正确的是
分类
组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
纯碱
H3PO4
CaCO3
CaO
SO2
B
苛性钠
HClO
NaCl
Na2O
CO
C
熟石灰
H2SO4
CuSO4•5H2O
Na2O2
CO2
D
烧碱
HCl
NaHCO3
Fe2O3
SO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验操作正确的是
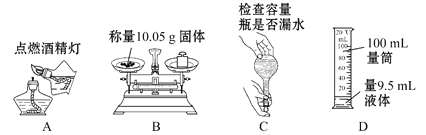
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式是
A. 石灰石与稀盐酸的反应:CO32-+2H+=H2O+CO2↑
B. Cl2通入水中: Cl2 +H2O=2H++Cl-+ClO-
C. 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
D. 稀盐酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
下列说法正确的是
A. 元素从化合态变为游离态,一定是被还原
B. 在标准状况下,水、氧气和氮气分子间的平均距离都相等
C. 0.5 mol·L−1的 MgCl2溶液中Cl−的数目为6.02×1023
D. 6.4g S2和S8的混合物,所含的硫原子数一定为1. 204×1023
难度: 中等查看答案及解析
-
《本草经集注》记载:“鸡屎矾(碱式硫酸铜或碱式碳酸铜)不入药用,投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变”。下列说法错误的是
A. 鸡屎矾属于盐类
B. “涂铁皆作铜色”是指与铁发生置换反应
C. 碱式硫酸铜和碱式碳酸铜都属于电解质
D. 鸡屎矾投苦酒中发生的是氧化还原反应
难度: 中等查看答案及解析
-
实现下列变化,一定要加入其它物质作氧化剂的是
A. Zn → ZnCl2 B. Cl2→ HClO
C. CaCO3→ CO2 D. CuO → CuSO4
难度: 中等查看答案及解析
-
在某无色透明的酸性溶液中,能大量共存的离子组是
A. Na+ 、K+、SO42-、CO32- B. Al3+、K+、SO42-、OH
C. Na+、 K+、Cl、 NO3 D. K+、Fe3+、MnO4-、I
难度: 中等查看答案及解析
-
根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是
①2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
②2FeCl3+2KI==2FeCl2+2KCl+I2
③2FeCl2+Cl2=2FeCl3
A. MnO4->Cl2>Fe3+>I2 B. Cl->Mn2+>I->Fe2+
C. MnO4-> Cl2>I2>Fe3+ D. I->Fe2+>Cl->Mn2+
难度: 中等查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是
A.
 B.
B. C.
D.
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 0.5 molNa2O2与足量的水反应产生5.6 L O2
B. 标准状况下,11.2 L酒精所含分子数为0.5NA
C. 常温常压下,1.6gCH4中含有的质子数为NA
D. 等物质的量的N2和CO所含分子数均为NA
难度: 中等查看答案及解析
-
科学家指出:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时一定不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C→砒霜(As2O3,剧毒)”。下面有关解释错误的是
A. 维生素C具有还原性 B. 青菜中含有维生素C
C. 维生素C能将+5价砷还原成+3价 D. 砒霜中毒后可服用维生素C解毒
难度: 中等查看答案及解析
-
2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中钯催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O=CO2+Pd↓+2HCl.下列说法正确的是
A. 题述反应中PdCl2被氧化
B. 反应中生成1molHCl时,转移的电子为2 mol
C. 上述反应中PdCl2是氧化剂,CO2是氧化产物
D. CO气体只有在高温下才能表现还原性
难度: 中等查看答案及解析
-
下列对1mol/L的Na2SO4溶液的叙述中,正确的是
A. 溶液中含有1mol Na2SO4
B. 将142g Na2SO4固体溶于1L水可得到1mol/L的Na2SO4溶液
C. 将142g Na2SO4·10H2O固体溶于少量水后,再将其稀释成1000mL
D. 从1mol/L的Na2SO4溶液中取出任意体积Na+的浓度都是2mol/L
难度: 中等查看答案及解析
-
物质的量浓度为0.05 mol·L-1的金属氯化物(RClx) 溶液20 mL,恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则x为
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析