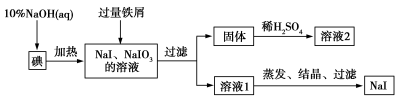
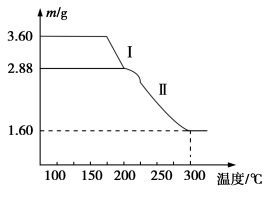
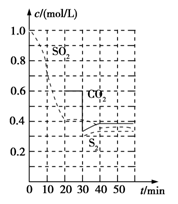
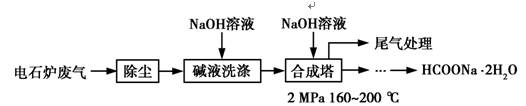
-
如图为雾霾的主要成分示意图。下列说法正确的是
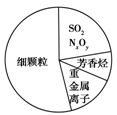
A.重金属离子可导致蛋白质盐析
B.芳香烃就是苯和苯的同系物
C.SO2和NxOy都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法不正确的是
A.5NH4NO3
2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA
B.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为4NA
D.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA
难度: 中等查看答案及解析
-
下列图中的实验方案,能达到实验目的的是

难度: 困难查看答案及解析
-
某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A.9 B.8 C.7 D.6
难度: 困难查看答案及解析
-
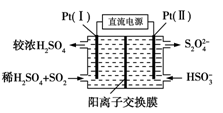
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是

A.放电时,电极A为负极,Na+由B向A移动
B.放电时,负极反应式为2Na-xe-===2Na+
C.充电时,电极B的反应式为
-2e-===xS
D.充电时,电极B接电源的负极
难度: 困难查看答案及解析
-
已知常温下浓度为0.1 mol·L-1的下列溶液的pH如下表所示:
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
下列有关说法正确的是
A.0.1 mol·L-1 Na2CO3溶液中,存在关系:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
B.加热0.1 mol·L-1 NaClO溶液测其pH,pH小于9.7
C.pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)=c(F-)>c(H+)=c(OH-)
D.根据上表数据得出三种酸电离平衡常数大小关系为:HF>HClO>H2CO3(一级电离平衡常数)
难度: 困难查看答案及解析
-
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是
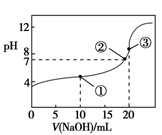
A.点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
B.点②所示溶液中:c(Na+)=c(CH3COO-)
C.点③所示溶液中:c(Na+) +c(H+)< c(CH3COOH)+c(CH3COO-) +c(OH-)
D.滴定过程中可能出现:c(CH3COOH)> c(H+)>c(CH3COO-)>c(Na+)>c(OH-)
难度: 困难查看答案及解析