-
下列说法中正确的是( )
A.反应热指的是反应过程中放出的热量
B.热化学方程式的化学计量数可表示分子的个数
C.在热化学方程式中无论反应物还是生成物必须标明聚集状态
D.所有的化学反应都伴随光能变化
难度: 简单查看答案及解析
-
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量 。则下列热化学方程式中正确的是( )
A.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
难度: 简单查看答案及解析
-
对于A2+3B22C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(A2)=0.4 mol·L-1·s-1 B.v(B2)=0.8 mol·L-1·s-1
C.v(C)=0.6 mol·L-1·s-1 D.v(B2)=42 mol·L-1·min-1
难度: 简单查看答案及解析
-
升高温度,下列数据不一定同时增大的是( )
A.化学反应速率v
B.弱电解质的电离平衡常数Ka
C.化学平衡常数K
D.水的离子积常数KW
难度: 简单查看答案及解析
-
可逆反应mA(g)
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
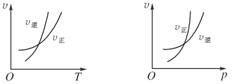
A.m>n,Q>0 B.m>n+p,Q>0
C.m>n,Q<0 D.m<n+p,Q<0
难度: 简单查看答案及解析
-
如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )

A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
难度: 简单查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
A.①⑤ B.③④
C.②⑤ D.②④
难度: 简单查看答案及解析
-
25 ℃时,向V mL pH=a的盐酸中滴加pH=b的氢氧化钠溶液10V mL时,溶液中Cl-的物质的量恰好等于Na+的物质的量,则此时a+b的值为( )
A.14 B.15 C.13 D.不能确定
难度: 简单查看答案及解析
-
物质的量浓度相同的下列溶液中:
①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4
⑤NH4HCO3 c(NH4+)由大到小的顺序是( )
A.⑤②③①④ B.④①③②⑤
C.③②①⑤④ D.③②④①⑤
难度: 简单查看答案及解析
-
(2011·本溪市高二期末)下列说法或表示法正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
C.温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动
D.酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性
难度: 简单查看答案及解析
-
(2011·焦作市高二期末)在下列溶液中,BaSO4的溶解度最大的是( )
A.1 mol/L H2SO4溶液 B.2 mol/L Na2SO4溶液
C.0.1 mol/L BaCl2溶液 D.纯水
难度: 简单查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水(l)和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-===2H2O(l)
C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-===4OH-(aq)
难度: 简单查看答案及解析
-
(2011·泉州一中高二期末)下列叙述正确的是( )
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释10倍后pH=4
C.0.2 mol·L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
难度: 简单查看答案及解析
-
(2011·宁波效实中学高二期末)一定量的气体在密闭容器中发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是( )
A.平衡向正反应方向移动
B.物质B的转化率降低
C.x+y<z
D.物质C的体积分数增大
难度: 简单查看答案及解析
-
(2011·山东莘县高二期末)图Ⅰ是NO2(g)+CO(g)
CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ;
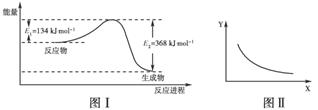
下列有关说法正确的是( )
A.该反应的焓变ΔH=+234 kJ·mol-1
B.若X表示体系的压强,则Y表示的可能是NO2的转化率
C.若X表示温度则Y表示的可能是CO2物质的量浓度
D.增大CO的起始浓度,平衡向正反应方向移动,反应热增大
难度: 简单查看答案及解析
-
(2011·本溪市高二期末)关于铅蓄电池的说法正确的是( )
A.充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO42-(aq)
B.充电时,电池中硫酸的浓度不断变小
C.放电时该电池的负极材料是铅板
D.放电时正极发生的反应是:Pb(s)+SO42-(aq)-2e-===PbSO4(s)
难度: 简单查看答案及解析