-
二氧化氯(ClO2) 作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。某研究小组设计如图所示装置制备ClO2和NaClO2。已知: ClO2熔点一59℃、沸点11℃,常温下ClO2为黄绿色或橘黄色气体,ClO2浓度过高或受热易分解,甚至会爆炸。NaClO2 高于60℃时分解生成NaClO3和NaCl。

(1)装置连接好后,加入药品前需进行的操作是____________________________________。
(2)使用恒压分液漏斗的目的是_________________;仪器B 的作用是_________________。
(3)A 中反应为2NaClO3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O。
C 中反应的化学方程式是_______________, 冷水浴的目的是_________________________。
(4) 实验中持续通入空气能稀释生成的ClO2并将其排到C处。若空气的流速太慢可能造成的后果是_______________________________________。
(5)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH≤2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。

用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为amol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取VmL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用cmol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为____mol/L( 用含字母的代数式表示)。
-
高铁酸钾(K2FeO4) 易溶于水。受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种的主要步骤如图所示(方框内为主产物)。

(1)①中反应的离子方程式是_____________________________。
(2)③中的反应为: Na2FeO4(s)+2KOH(aq)  K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
(3) 提纯粗K2FeO4采用的方法是___________________(选填“萃取”、“蒸馏”、“重结晶”)。提纯过程中溶解粗K2FeO4 固体应选用__________(填序号)。
A.水 B.稀硫酸 C.KOH 溶液 D.NaOH 溶液
(4)某温度下,高铁酸钾溶液在不同pH 下的分解曲线如图所示。为延长高铁酸钾溶液的保存时间,可采取的措施是________________;完成pH>7 时的化学反应方程式配平:__ K2FeO4 +___=___KOH+___Fe(OH)3↓+________,____________________
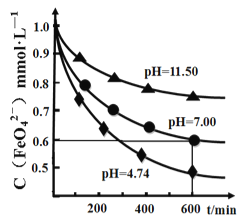
(5)用高铁酸钾处理污水,能去污、杀菌、消毒,且自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现用两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30mg K2FeO4,相同温度下最终去除效果见下表。
| 项目 | 葡萄糖溶液 | 甲苯溶液 |
| 起始COD/(mg·L-1) | 1124 | 1966 |
| 处理后COD/(mg·L-1) | 983 | 526 |
| 去除率/% | 11.54 | 73.24 |
已知: 化学需氧量(COD) 指的是: 在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧气的亳克数,以mg·L-1表示。该指标也作为污水中有机物含量的综合指标之一。由甲苯引起的1L 污水,当去除率为73.24%时,理论上需高铁酸钾_____mg。[ 已知 :M(K2FeO4)=198g/mol]。理论上需要的m (Na2FeO4 ) 大于实际用量,说明Na2FeO4 去除有机污水的原理除了氧化作用外,另一个原因可能是_____________________________。
-
甲醇(CH3OH)是重要的有机化工原料,可用于制取氢气、甲酸甲酯(HCOOCH3)。(1) 在一定条件下用氧气催化氧化甲醇制氢气,原料气中n(O2)/n(CH3OH)对反应的选择性影响如图所示(选择性越大表示生成的该物质越多)。当n(O2)/n(CH3OH)=0.25 时,主要反应的化学方程式为____________,制备H2 时最好控制n(O2)/n(CH3OH)=___________。

(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g) HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=_________________。
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为____ mol·L-1·min-1,若平衡时气体总压为P总=5×104Pa,Kp=_______。(已知: Kp是用平衡气体分压代替平衡浓度求得的平衡常数。气体分压=气体总压×气体的物质的量分数)。若在310℃下,将2mol 甲醇置于VL恒压密闭容器中,反应到达平衡时甲醇的分压______氢气的分压(填“>”,“=”或“<”)。
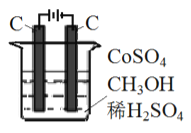
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式_______________________________________。
②除去甲醇的离子方程式为_________________________。
-
N 是一种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子的核外电子排布式是_____________;最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________。
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。

(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是________。
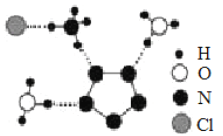
A.所有N 原子的价电子层均有孤对电子 B.两种阳离子均含有配位键
C.两种阳离子不是等电子体 D.阴阳离子之间只存在离子键
(4)NH3 与F2 反应生成NF3 和NH4F,这四种物质中,沸点由高到低的顺序是______;NF3中氮元素显_______价;属极性分子的有_________________。
(5)立方氮化硼称为超硬材料。晶胞结构如图所示:
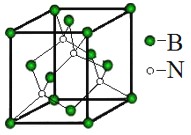
硼原子的配位数是__________。若晶胞参数为anm,则晶体的密度为____g·cm3 (用NA 表示阿伏伽德罗常数的值,列出代数式)。
-
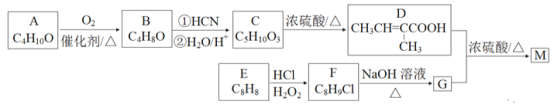
由烃的衍生物A和芳香烃E 制备香精的重要原料M 的一种合成路线如下:
已知:
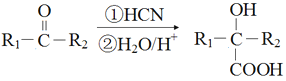 (R1、R2表示烃基或H 原子)
(R1、R2表示烃基或H 原子)
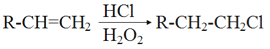
请回答下列题:
(1)A的化学名称为__________________,B 的结构简式为____________________。
(2)C 中官能团的名称为__________________。D 分子中最多有__________个原子共平面。
(3)E→F的反应类型为___________________。D+G→M 的化学方程式为____________。
(4)同时满足下列条件的D 的同分异构体有____种(不考虑立体异构),其中核磁共振氢谱有3 组峰的结构简式为__________________。
①能发生水解反应和银镜反应; ②不含环状结构
(5)参照上述合成路线和信息。以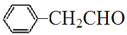 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备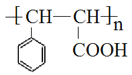 的合成路线_____________________。
的合成路线_____________________。
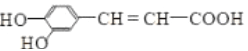 )能使酸性高锰酸钾溶液褪色
)能使酸性高锰酸钾溶液褪色












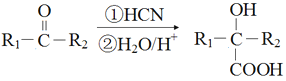 (R1、R2表示烃基或H 原子)
(R1、R2表示烃基或H 原子)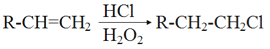
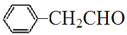 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备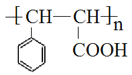 的合成路线_____________________。
的合成路线_____________________。