-
《本草纲目》记载:“烧酒,其法用浓酒和糟人甑,蒸令气上,用器承滴露”,“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可用于分离
A. 硝酸钾和氯化钠 B. 碘单质和氯化铵 C. 泥水和氢氧化铁胶体 D. 溴苯和苯
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A. “84”消毒液的有效成分是NaC1O
B. 用灼烧的方法可以区分蚕丝和人造纤维
C. 碳酸钡可用于胃肠X射线造影检查
D. 在汽车尾气系统中使用催化转化器,可减少CO、NOx等的排放
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 羟基的电子式:
B. 中子数为16的磷原子:3115P
C. 氟原子的结构示意图:
D. HClO的结构式:H-C1-O
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值。下列说法正确的是
A. 24.0g镁与27.0g铝含有相同的质子数
B. 密闭容器中,2.0 mol SO2和1.0 mol O2催化反应后分子总数为2NA
C. 标准状况下,11.2L由甲烷和乙烯组成的物质中含氢原子数为2NA
D. 1.0mol CH4与Cl2在光照下反应生成的CH3Cl分子数为NA
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液: Fe3+、Mg2+、SCN-、Cl-
B. 0.1 mol/LCuSO4溶液: Na+、NH4+、NO3-、A13+
C. 0.1 mol/LNaOH溶液: Ca2+、Na+、SO42-、HCO3-
D. 0.1 mol/LKI溶液: Na+、K+、ClO-、H+
难度: 中等查看答案及解析
-
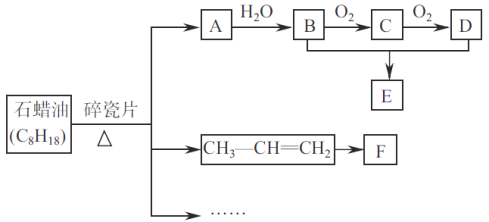
下列关于有机化合物的说法正确的是
A. 淀粉和纤维素互为同分异构体
B. 蛋白质水解的最终产物是多肽
C. 植物油含不饱和脂肪酸酯,能使溴的四氯化碳溶液褪色
D. 煤油可由煤的干馏获得,可用作燃料和保存少量金属钠
难度: 简单查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如下图。下列关于莽草酸的说法正确的是
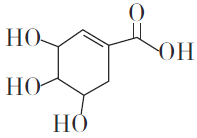
A. 分子式为C7H6O5
B. 可发生加成和取代反应
C. 分子中含有两种官能团
D. 1mol莽草酸与足量的Na反应,生成标准状况下33.6L的H2
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 用醋酸除去水垢: 2H+ +CaCO3=Ca2++CO2↑+H2O
B. 向Ba(OH)2溶液中滴加稀硫酸: Ba2++OH-+H++SO42-==BaSO4↓+H2O
C. 用氢氧化钠溶液吸收少量二氧化硫气体: SO2+OH-=HSO3-
D. 将铜插入稀硝酸中: 3Cu+8H++2NO3-==3Cu2++2NO↑ +4H2O
难度: 困难查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO的物质的量最多的是
A. Fe B. FeO C. Fe2O3 D. Fe3O4
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A. L层上的电子数为奇数的元素一定是主族元素
B. 核外电子排布相同的微粒化学性质也相同
C. IA族元素的金属性一定比IIA族元素的金属性强
D. 同周期金属元素的化合价越高,其原子失电子能力越强
难度: 中等查看答案及解析
-
下图为周期表中短周期的一部分,W、X、Y、Z四种元素最外层电子数之和为24。下列说法正确的是
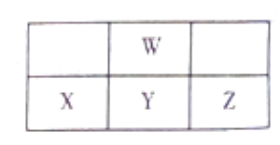
A. X、Y、Z的含氧酸的酸性依次增强
B. W元素形成的单核阴离子还原性强于X
C. Y、W形成的化合物一定能使酸性KMnO4溶液褪色
D. W与氢元素形成的化合物中可能含有非极性键
难度: 中等查看答案及解析
-
工业合成氨反应N2+3H2
2NH3,是一个正反应为放热的可逆反应。下列说法正确的是
A. 使用合适的催化剂可以加快反应速率,提高生产效率
B. 生成物的总能量大于反应物的总能量
C. 将该反应设计成原电池,放出的热量不变
D. 达到平衡时,N2的浓度与NH3的浓度一定相等
难度: 中等查看答案及解析
-
由a、b、c、d四种金属按下表中装置进行实验。下列说法正确的是
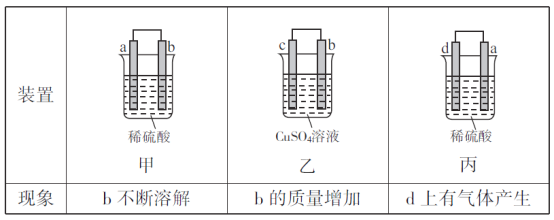
A. 装置甲中化学能全部转化为电能
B. 装置乙中b电极发生的电极反应式为Cu2++2e-=Cu
C. 装置丙中SO42-向a电极移动,溶液的pH变小
D. 四种金属活动性由强到弱的顺序是b>e>d>a
难度: 中等查看答案及解析
-
加碘食盐中的碘以KIO3形式存在。根据反应:IO3-+5I-+6H+==3I2+3H2O,可用碘化钾淀粉试纸和食醋进行实验,证明食盐中存在IO3-。下列说法错误的是
A. 实验时可观察到试纸变为蓝色
B. 实验可证明该条件下氧化性: IO3-> I2
C. 每生成3 mol I2转移电子的物质的量6 mol
D. 该反应中IO3-作氧化剂,发生还原反应
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B
证明淀粉水解后产生葡萄糖
淀粉溶液加稀硫酸,水浴加热一段时间后,加新制的Cu(OH)2悬浊液,加热
C
配制 0.1000 mol/L的NaOH溶液
称取1.0 g NaOH固体于烧杯中,加人少量蒸馏水溶解,转移至250mL 容量瓶中定容
D
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
A. A B. B C. C D.
难度: 中等查看答案及解析
-
一定温度下,在容积为2 L的密团容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。据图可知
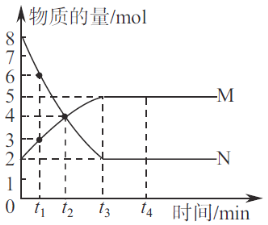
A. 该反应的化学方程式为N(g)
2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
C. t2时,正逆反应速率相等,反应达平衡状态 D. 平衡时,物质N的转化率为75%
难度: 中等查看答案及解析