-
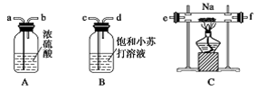
钠着火燃烧时,可用下列哪种物质灭火
①泡沫灭火器 ②干粉灭火器 ③水 ④沙土
A.①② B.④ C.②③ D.①②③
难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是
A.“另一种反应物”一定具有还原性
B.CuH既可做氧化剂也可做还原剂
C.CuH+Cl2=CuCl+HCl(燃烧)
D.CuH+HCl=CuCl+H2↑(常温)
难度: 中等查看答案及解析
-
下列各组离子在指定条件下,一定能大量共存的是
A.pH=1的无色溶液:Na+、Cu2+、NO3-、SO42-
B.能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3-
D.能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.分子数为NA的CO、
混合气体体积约为22.4L,质量为28g
B.常温常压下,92g的NO2和N2O4混合气体含有的原子数为4NA
C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA
D.78g
固体与H2O完全反应转移的电子数为NA
难度: 中等查看答案及解析
-
,能实现上述物质间直接转化的元素
A.硅 B.硫 C.铜 D.铁
难度: 中等查看答案及解析
-
FeCl3溶液、Fe(OH)3胶体共同具备的性质是
A.都呈透明的红褐色
B.分散质颗粒直径相同
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.都能产生丁达尔现象
难度: 中等查看答案及解析
-
同温同压下,等容积的两容器内分别充满14N18O和13C18O气体。下列说法正确的是
A.所含分子数和质量均不相同 B.含有相同的分子数和电子数
C.含有相同的质子数和中子数 D.含有相同数目的中子、原子和分子
难度: 中等查看答案及解析
-
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
难度: 中等查看答案及解析
-
已知氧化还原反应反应 K2Cr2O7 + 14HCl
== 2KCl + 2CrCl3 + 3Cl2+ 7H2O
关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7 ②还原性:Cl->Cr3+
③每生成1mol Cl2,电子转移为6mol ④CrCl3是氧化产物
A.①② B.①②④ C.①③④ D.①③
难度: 中等查看答案及解析
-
下列物质的溶液在空气中长期放置,其pH的变化与图示相符的是
①Ca(ClO)2 ②H2SO3 ③氯水 ④NaOH ⑤浓HCl
A.①②④ B.②③⑤ C.②③ D.①④⑤
难度: 中等查看答案及解析
-
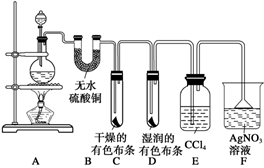
下列有关化学反应过程或实验现象的叙述中,正确的是
A.氯气的水溶液可以导电,说明氯气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D.为证明氯水中含Cl-,可先加盐酸酸化,再加入AgNO3溶液
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O
B.二氧化硫通入次氯酸钠溶液:SO2 + ClO- + 2OH–= SO42-+Cl-+ H2O
C.硫化钡加入稀硫酸:BaS + 2H+ = H2S↑+ Ba2+
D.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
难度: 中等查看答案及解析
-
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物:
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝的存在形式:
D.氨水与SO2反应后溶液中的铵盐:
难度: 中等查看答案及解析
-
为提高农作物产量,改善农作物品质,有一种向温室内定期施放
的方法是:将工业废稀
按1:4用水稀释后,盛放在塑料桶内悬挂于1.2米的高处,每天向桶内加入适量的某物质。下列物质中最适宜加入的是
A.
B.
粉末
C.
粉末 D.
粉末
难度: 中等查看答案及解析
-
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红
C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
D.氯水中形成次氯酸的反应中还原产物是HClO
难度: 中等查看答案及解析