-
下列措施不合理的是( )
A.用SO2漂白纸浆和草帽
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是 ( )
A.30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA
B.1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA
C.100mL0.2mol·L-1的AlCl3溶液中,含Al3+数为0.02NA
D.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
难度: 中等查看答案及解析
-
下列实验可实现鉴别目的是( )
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
难度: 简单查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2
⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
难度: 困难查看答案及解析
-
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
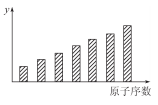
A.y轴表示的可能是基态的原子失去一个电子所需要的最小能量;
B.y轴表示的可能是原子在化合物中吸引电子的能力标度;
C.y轴表示的可能是原子半径;
D.y轴表示的可能是形成基态离子转移的电子数
难度: 困难查看答案及解析
-
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时, a:b不可能为
A.3:4 B.4:5 C.2:3 D.3:2
难度: 困难查看答案及解析
-
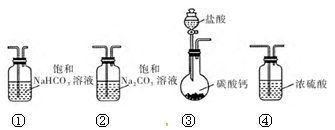
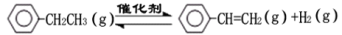
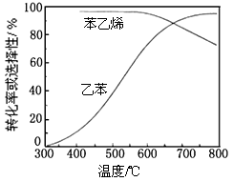
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )

A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气
难度: 中等查看答案及解析
-
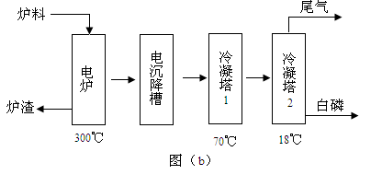
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程:
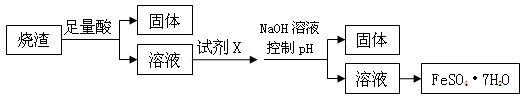
下列说法不正确的是 ( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 困难查看答案及解析
-
对于合成氨反应,达到平衡后,以下分析正确的是( )
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
难度: 中等查看答案及解析
-
一般情况下,前者无法决定后者的是( )
A.原子核外电子排布﹣﹣元素在周期表中的位置
B.弱电解质的相对强弱﹣﹣电离常数的大小
C.分子间作用力的大小﹣﹣分子稳定性的高低
D.物质内部储存的能量﹣﹣化学反应的热效应
难度: 中等查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
A.硫元素被氧化
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2
难度: 困难查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应.下列说法错误的是( )
A.元素丙的单质可用于冶炼金属
B.甲与丁形成的分子中有非极性分子
C.简单离子半径:丁>乙>丙
D.甲与乙形成的化合物均有氧化性
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)
COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
难度: 困难查看答案及解析
-
已知热化学方程式如下:
CaSO4(s)+CO(g)
CaO(s) + SO2(g)+CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)
CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( )

难度: 困难查看答案及解析
-
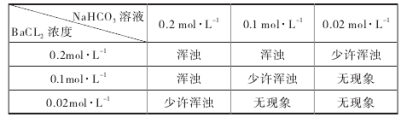
某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色。
该同学最终确定在上述六种离子中公含NO2-、CO32-、Cl-三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
难度: 困难查看答案及解析
-
某小组用右图装置进行实验,下列说法正确的是( )
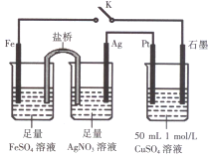
A.盐桥中的电解质可以用KC1
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成
难度: 中等查看答案及解析
-
在一定温度下可逆反应N2+3H2
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成nmolN2,同时生成2nmolNH3
⑦气体的平均相对分子质量不再改变
⑧N2H2NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
A、①②③④⑤⑥⑦⑨ B、①②③⑤⑥⑩ C、③④⑤⑥⑦ ⑧ D、①②③⑤⑥⑦⑨⑩
难度: 困难查看答案及解析