-
我国纪念“世界水日”和“中国水周”活动的宣传主题为“节约保护水资源,大力建设生态文明”,下列说法或做法不符合这一主题的是
A.科学使用农药、化肥,减少水体污染
B.工业废水和城市生活污水需净化处理,坚持达标排放
C.为了节约生产成本,可将造纸厂、化工厂建在水源的上游
D.合理开发水资源,建设水资源节约型和环境友好型经济
难度: 简单查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
铝具有强还原性
可以通过置换反应产生氢气
B
二氧化硅不与任何酸反应
可用石英制造耐酸容器
C[
浓H2SO4有吸水性
浓H2SO4可用于干燥NH3
D
Fe2O3溶于酸
可作红色涂料
难度: 中等查看答案及解析
-
下列有关化学实验安全问题的叙述中不正确的是
A.闻化学药品的气味时都不能使鼻子凑近药品
B.点燃氢气前要检查纯度,以免发生爆炸
C.在盛O2集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子
D.凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
难度: 简单查看答案及解析
-
实验室制取少量干燥的氨气涉及下列装置,其中正确的是

A.①是氨气发生装置 B.③可用于氨气的发生装置
C.②是氨气吸收装置 D.④是氨气收集、检验装置
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物;②煤和石油都是可再生能源;③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体。上述说法正确的是
A.①②④ B.①⑤⑥ C.①③④⑥ D.②③④⑤
难度: 中等查看答案及解析
-
若NA为阿伏加德罗常数的值,下列说法正确的是
A.NA个Fe(OH)3胶体粒子的质量为107g
B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
C.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA
D.5.6gFe与0.1mol Cl2完全反应,反应中转移的电子数为0.3NA
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.将一定量的Al片投入足量的NaOH溶液中:2Al+2OH-+2H2O =2AlO2-+3H2↑
难度: 中等查看答案及解析
-
下列关于钠的说法中不正确的是
A.金属钠和氧气反应,条件不同,产物则不同
B.将钠投入氯化铵溶液中会有无色有刺激性气味的气体生成
C.当钠与硫酸铜溶液反应时,有大量红色固体铜生成
D.钠的化学性质比较活泼,少量的钠可以保存煤油中
难度: 中等查看答案及解析
-
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是
A.Ca2+、K+、OH-、Cl-、NO3- B.Al3+、Na+、Cl-、SO42-、NO3-
C.Fe2+、H+、Br-、NO3-、Cl- D.Na+、K+、SO42-、NO3-、Cl-
难度: 中等查看答案及解析
-
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2.将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是
A.V=2.24L
B.参加反应的HCl为0. 18mol
C.无法确定最终生成含钾化合物的数量是多少
D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2(标准状况)
难度: 困难查看答案及解析
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:①3SiO2+6C+2N2
Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3
Si3N4+12HCl.则下列叙述正确的是
A.反应②属于离子反应
B.若制取等量的Si3N4,则反应①②转移电子数目必然相等
C.反应①的氧化剂是N2
D.反应①中氧化产物与还原产物物质的量之比为1:6
难度: 困难查看答案及解析
-
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断不正确的是:
A.溶液中共发生了1个氧化还原反应
B.反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
C.有胶状物质生成
D.溶液颜色发生变化
难度: 困难查看答案及解析
-
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.
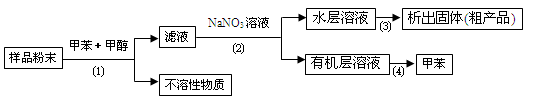
下列说法错误的是
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
难度: 中等查看答案及解析
-
某气体由常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为3:8,则关于该气体的说法正确的是
A.该气体一定是纯净物 B.该气体一定是CO、CO2的混合物
C.该气体中所含的物质最多只有2种 D.该气体可能含有3种成分
难度: 中等查看答案及解析
-
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图.其中甲和X可能是
A.甲为Fe、X为Cl2
B.甲为S、X为O2
C.甲为SO2、X为NaOH溶液
D.甲为AlCl3溶液、X为NH3·H2O
难度: 中等查看答案及解析
-
磁流体是电子材料的新秀,它是由直径为纳米量级(1到10纳米之间)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁流体的说法中不正确的是
A.纳米Fe3O4磁流体分散系属于溶液
B.纳米Fe3O4磁流体可以通过渗析法得到提纯
C.当一束可见光通过该磁流体时会出现光亮的通路
D.纳米Fe3O4磁流体比较稳定.
难度: 中等查看答案及解析
