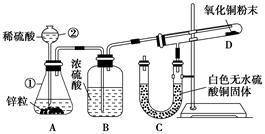
-
一定条件下,RO
和氟气可发生如下反应RO
+F2+2OH-===RO
+2F-+H2O,从而可知在RO
中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
难度: 中等查看答案及解析
-
在溶液中能大量共存,加入OH—有沉淀析出,加入H+有气体放出的是
A.Na+、Cu2+、Cl—、SO42— B.Fe3+、K+、SO42—、NO3—
C.H+、Al3+、OH—、NO3— D.Na+、Ca2+、Cl—、HCO3—
难度: 困难查看答案及解析
-
同温同压下,甲、乙两容器分别盛有CH4和NH3,已知它们所含氢原子个数相同,则甲、乙两容器的体积比为
A.4∶3 B.5∶4 C.4∶5 D.3∶4
难度: 中等查看答案及解析
-
CO和H2的混和气体的摩尔质量为8.5 g/mol,则此混和气体中CO和H2的物质的量之比是:
A.1:3 B.3:1 C.1:14 D.14:1
难度: 中等查看答案及解析
-
如果
g某气体中含有的分子数为
,则
g该气体在标准状况下占有的体积应表示为(式中
为阿伏加德罗常数)
A.
B.
C.
D.
难度: 中等查看答案及解析
-
上海磁悬浮铁路是世界上第一条投入运营的商业磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量分别为
A.0.50、0.50、0.50 B.0.50、1.0、1.5
C.0.25、1.0、1.5 D.1.0、0.25、0.17
难度: 中等查看答案及解析
-
下列实验操作中,不能用于物质分离的是

难度: 简单查看答案及解析
-
下列属于强电解质的是
A.醋酸 B.酒精 C.铜 D.小苏打
难度: 简单查看答案及解析
-
进行化学实验必须注意安全,下列说法正确的是
A.可燃性气体在加热或点燃前,必须先检验其纯度
B.浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后抹上碳酸钠溶液
C.配制硫酸溶液时,先在量筒中加入一定量的水,再慢慢加入浓硫酸
D.鉴别食盐和纯碱,可用口尝药品的味道,有咸味者,则为食盐
难度: 中等查看答案及解析
-
下列反应中符合H+ + OH—= H2O离子反应的是
A.稀硫酸与稀氨水 B.稀硫酸与氢氧化钡溶液
C.浓硝酸与氢氧化钡溶液 D.盐酸与氢氧化铁胶体反应
难度: 中等查看答案及解析
-
日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
A.铜质奖章上出现铜绿[Cu2(OH)2CO3] B.充有H2的气球遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏 D.轮船底部生锈
难度: 中等查看答案及解析
-
在酸性溶液中,可大量共存的离子是
A.K+ Na+ OH— SO42— B.Mg2+ SO42— NH4+ Cl—
C.K+ Na+ HCO3— Cl— D.K+ Na+ NO3— CO32—
难度: 中等查看答案及解析
-
2012年8月26日,延安高速公路发生特大交通事故,造成36人死亡,3人受伤。起因是由于客车与装有甲醇的罐车相撞。对危险化学品要在包装标签上印有警示性标志。甲醇应选用的标志是




A B C D
难度: 简单查看答案及解析
-
已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是
A.蒸馏 B.分液 C.过滤 D.蒸发
难度: 简单查看答案及解析
-
胶体区别于其它分散系的本质特征是
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
难度: 简单查看答案及解析
-
除去NaCl中混有的 MgCl2、Na2SO4时选用
A.NaOH、Ba(NO3) 2、Na2CO3、HCl
B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl
C.NaOH、BaCl2、Na2CO3、HCl
D.Na2CO3、BaCl2、HCl
难度: 困难查看答案及解析
-
甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录如下
表,其中记录合理的是
甲
K2SO4、BaCl2、NH4NO3
乙
NaCl、Ca(OH)2、K2CO3
丙
HCl、Na2SO3、NaCl
丁
K2SO4、NaNO3、KCl
A.甲 B.乙 C.丙 D.丁
难度: 困难查看答案及解析
-
根据下列三个反应的化学化学方程式,判断下列关系式不正确的是
(1)I2+SO2+2H2O===H2SO4+2HI (2)2FeCl3+2HI===2FeCl2+2HCl+I2
(3)2FeCl2+Cl2===2FeCl3
A.氧化性:Cl2>Fe3+>I2>H2SO4 B.还原性:SO2>I->Fe2+>Cl-
C.2Fe+3I2===2FeI3 D.FeI2+Cl2===FeCl2+I2(Cl2不足时)
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42—===BaSO4↓+H2O
B.向NaHSO4溶液滴入NaHCO3溶液:HCO
+HSO4-==CO2↑+H2O+SO42—
C.Na2CO3溶液中通入CO2:CO
+CO2+H2O===2HCO
D.CH3COOH溶液与NaOH溶液反应:H++OH-===H2O
难度: 困难查看答案及解析
-
用NA表示阿伏德罗常数的数值,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.常温常压下,1 NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl—个数为1 NA
难度: 困难查看答案及解析
-
在200mL某硫酸盐溶液中,含硫酸根离子1.5NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为
A.2.5mol/L B.5mol/L C.7.5mol/L D.2mol/L
难度: 中等查看答案及解析
-
标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3,下列对四种气体的关系从小到大表示不正确的是
A.体积 ④<①<③<② B.密度 ①<④<③<②
C.质量 ④<①<③<② D.氢原子数 ④<②<③<①
难度: 困难查看答案及解析
-
用下图表示的一些物质或概念间的从属关系中不正确的是
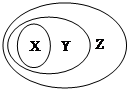
X Y Z
A 氧化物 化合物 纯净物
B 胶体 分散系 混合物
C 电解质 酸、碱、盐 化合物
D 碱性氧化物 金属氧化物 氧化物
难度: 中等查看答案及解析
-
在Na2SO4、NaCl、NaOH的混合溶液中,Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
难度: 中等查看答案及解析
-
下列溶液中Cl-的物质的量浓度最小的是
A.200mL 2mol/L MgCl2溶液 B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液 D.300mL 5mol/L KClO3溶液
难度: 中等查看答案及解析