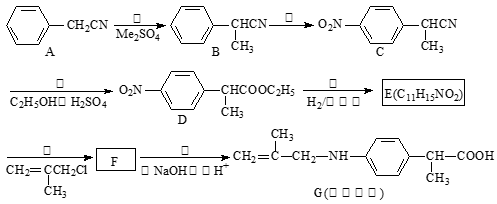
-
下列叙述不正确的是
A.漂白粉的有效成分是Ca(ClO)2 B.胆矾的成分是CuSO4·5H2O
C.医疗上用的“钡餐”成分是BaSO4 D.光导纤维主要成分是Si
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法中,正确的是
A.1.8g重水(D2O)中含有的质子数为1.0 NA
B.500℃、30MPa下:N2(g)+3H2(g)
2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ。
C.标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.60 g石英晶体中含有的Si-O键数目为2NA
难度: 中等查看答案及解析
-
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是
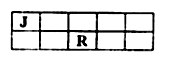
A.J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
难度: 中等查看答案及解析
-
下列化学原理表述正确的是
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大;
B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-+H2O
CO32-+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多;
难度: 中等查看答案及解析
-
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是
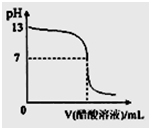
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
难度: 中等查看答案及解析
-
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
A.该反应的化学方程式是2HF
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是
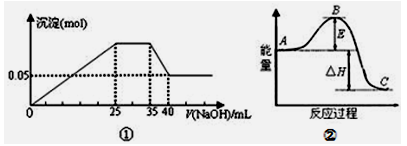
A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2
B.图①中使用的NaOH的浓度为2mol/L
C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低
D.图②中物质A反应生成物质C,△H>0;
难度: 中等查看答案及解析