-
下列各组混合物中,能用分液漏斗进行分离的是
A.苯和CCl4 B.溴和CCl4 C.酒精和水 D.汽油和水
难度: 简单查看答案及解析
-
下列实验操作均用到玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
难度: 简单查看答案及解析
-
下列电离方程式书写正确的是
A.Fe2(SO4)3=2Fe+3+3SO4-2 B.CuCl2=Cu2++Cl2-
C.NaOH=Na++OH- D.CH3COOH=CH3COO-+H+
难度: 中等查看答案及解析
-
右图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是
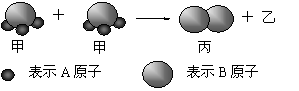
A.化学反应中分子的种类发生了改变
B.该反应类型是分解反应
C.反应生成的丙物质属于单质
D.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子
难度: 中等查看答案及解析
-
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
A.水的沸点;水分子的数目 B.水的密度;水的摩尔质量
C.水的体积;水中所含原子的数目 D.水的质量;水的相对分子质量
难度: 中等查看答案及解析
-
有以下物质 ①NaNO3溶液 ②熔融的MgCl2 ③CuSO4粉末 ④NaOH固体 ⑤金属铜 ⑥蔗糖。有关它们的说法正确的是
A.能导电的有①②③④⑤ B.属于电解质有①②③④
C.不能导电的有③④⑥ D.属于纯净物的只有④⑤⑥
难度: 中等查看答案及解析
-
下列分类正确的是
A.酸:CH3COOH、H2SO3、NaHCO3、NaHSO4
B.碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2
C.盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2
D.氧化物:FeO、N2O5、CaCO3、SiO2
难度: 中等查看答案及解析
-
10 g 10%的氢氧化钠溶液稀释成50 mL,所得氢氧化钠溶液的物质的量浓度为
A.0.02 mol/L B.0.05 mol/L C.0.25 mol/L D.0.5 mol/L
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.石灰石与盐酸反应 CO32-+2H+=CO2↑+H2O
B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓
C.氢氧化铜和硫酸反应 OH-+H+=H2O
D.铁钉放入硫酸铜溶液中 2Fe+3Cu2+=2Fe3++3Cu
难度: 中等查看答案及解析
-
H-是负一价的阴离子,它可与NH3发生以下反应:H-+NH3 = H2+NH2-,下列有关这个反应的说法中正确的是
A.它属于置换反应
B.反应中被氧化和被还原的元素都是H元素
C.该反应中NH3被氧化
D.该反应中H-是氧化剂
难度: 中等查看答案及解析
-
150℃时, NH4HCO3分解为NH3、H2O、CO2三种物质,此时混合气的密度是相同条件下的氢气密度的大约
A.26.3倍 B.15.25倍 C.13.2倍 D.12倍
难度: 中等查看答案及解析
-
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是
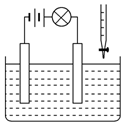
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中逐滴加入稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
难度: 中等查看答案及解析
-
在标况下,下列气体含有的分子数最多的是
A.36.5g HCl B.4 mol H2O C.4g H2 D.0.5mol SO2
难度: 中等查看答案及解析
-
根据下列反应,有关离子的还原性强弱顺序正确的是
①2Fe3++ 2I-=2Fe2++ I2 ②2Fe2++ Br2=2Fe3++ 2Br-
A.Br->I->Fe2+ B.Fe2+>I->Br-
C.Br->Fe2+>I- D.I->Fe2+>Br-
难度: 中等查看答案及解析
-
下列各组微粒,在溶液中能大量共存的是
A、K+、H+、NO3—、Cl— B、Cu2+、Cl—、OH¯、SO42—
C、H+、Na+、HCO3—、Cl— D、Ca2+、Cl—、K+、CO32—
难度: 中等查看答案及解析
-
现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 3mol·L-1硫酸,恰好完全溶解,若mg该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为
A.(m-1.6)g B.(m-2.4)g C.(m-4.8)g D.无法计算
难度: 中等查看答案及解析
-
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是其水溶液),盐酸必须避开它们,否则就无法通过。
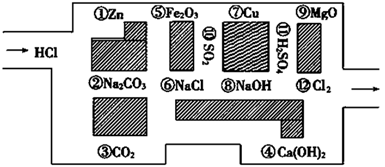
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________________。
(2)在不能与稀盐酸反应的物质中,属于电解质的是____________,属于非电解质的是____________。
(填写物质前的序号)
(3)能与稀盐酸发生氧化还原反应的是________。
难度: 中等查看答案及解析