-
下列说法正确的是
A. 氢氧燃料电池工作时,
在负极上失去电子
B.
溶液加热后,溶液的pH减小
C. 常温常压下,
中含有的分子数为
个
D. 室温下,稀释
溶液,溶液的导电能力增强
难度: 中等查看答案及解析
-
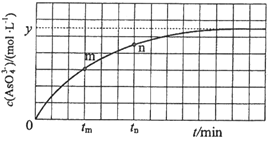
下列关于
溶液的说法正确的是
A. 溶质的电离方程式为
B.
时,加水稀释后,
与
的乘积变大
C. 离子浓度关系:
D. 温度升高,
增大
难度: 中等查看答案及解析
-
运用相关化学知识进行判断,下列结论错误的是
A. 某吸热反应能自发进行,因此该反应是熵增反应
B. NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C. 可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D. 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
难度: 中等查看答案及解析
-
下列关于化学平衡常数
,电离平衡常数
或
,水解平衡常数
,沉淀溶解平衡常数
,水的离子积常数
的叙述中错误的是
A. K值越大,正反应进行的程度越大,一般地说,
时,该反应进行得就基本完全了
B. 比较
与离子积
的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C. K、
或
、
、
、
都与温度有关,温度越高,常数值越大
D. 弱酸HA的
与NaA的
、水的离子积常数
三者间的关系可表示为:
难度: 困难查看答案及解析
-
下列关于电解质溶液中离子关系的说法正确的是
A.
溶液中离子浓度关系:

B.
和
等体积混合后离子浓度关系:
C. 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的
,则混合溶液中:
D. 常温下,在
的溶液中,
、
、
、
能大量共存
难度: 困难查看答案及解析
-
下列说法正确的是
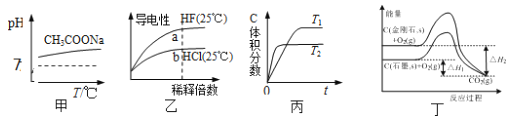
A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点Kw的数值比b点Kw的数值大
C. 由图丙可知,反应A(g)+B(g)
2C(g)是吸热反应
D. 由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
难度: 简单查看答案及解析
-
下列比较中,正确的是
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.
和
溶液等体积混合后:
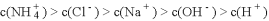
C. 物质的量浓度相等的
和NaHS混合溶液中:
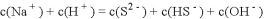
D. 同浓度的下列溶液中,
、
、
、
;
由大到小的顺序是:
难度: 困难查看答案及解析
-
(题文)常温下,用
溶液滴定
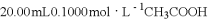 溶液所得滴定曲线如图
溶液所得滴定曲线如图下列说法正确的是
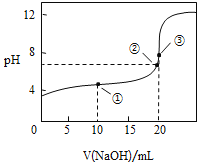
A. 点
所示溶液中:
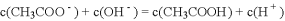
B. 点
所示溶液中:

C. 点
所示溶液中:
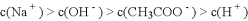
D. 滴定过程中可能出现:
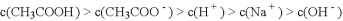
难度: 困难查看答案及解析
-
溴酸银(AgBrO3)溶解度随温度变化曲线如图3-4-2所示。下列说法错误的是( )
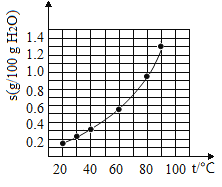
A. 溴酸银的溶解是放热过程
B. 温度升高时溴酸银的溶解速率加快
C. 60℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
难度: 困难查看答案及解析
-
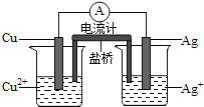
三室式电渗析法处理含
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
和
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室
下列叙述正确的是
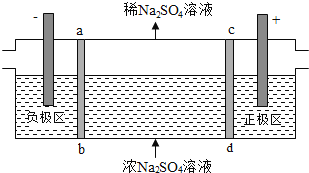
A. 通电后中间隔室的
离子向正极迁移,正极区溶液pH增大
B. 该法在处理含
废水时可以得到NaOH和
产品
C. 负极反应为
,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有
的
生成
难度: 困难查看答案及解析
-
根据下列操作及现象,所得结论不正确的是
序号
操作及现象
结论
A
将
的氨水稀释10倍,测得pH由11变成
的电离程度增大
B
“
球”浸泡在热水中,颜色加深
C
向25mL冷水和沸水中分别滴入5滴
饱和溶液,前者为黄色,后者为红褐色
温度升高,
的水解程度增大
D
将固体
加入
饱和溶液中,一段时间后,检验固体成分为
同温下溶解度:
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是
A. 向
溶液中加入少量水,溶液中
减小
B. 将
溶液从
升温至
,溶液中
增大
C. 向盐酸中加入氨水至中性,溶液中
D. 向AgCl、AgBr的饱和溶液中加入少量
,溶液中
不变
难度: 困难查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
已知
容器
甲
乙
丙
反应物的投入量
、
的浓度
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系的压强
反应物的转化率
下列说法正确的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A. 反应前2 min的平均速率ν(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 molZ,平衡时X的体积分数增大
难度: 中等查看答案及解析
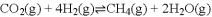
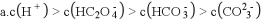
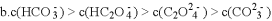
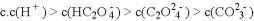
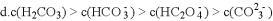
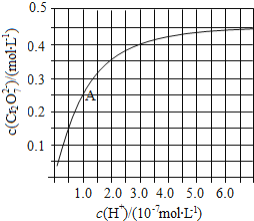
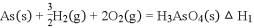
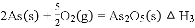
 溶液中
溶液中