-
化学与生产生活息息相关。下列说法不正确的是( )
A. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
B. “火树银花”中的烟火颜色实质上是金属元素的焰色反应
C. 食盐可作调味剂,也可作食品防腐剂
D. “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸是用蚕丝加工成的,蚕丝的主要成分是蛋白质,它属于高分子化合物
难度: 简单查看答案及解析
-
下列各反应对应的离子方程式正确的是( )
A. 向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C. 向NaHSO4溶液中加足量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D. 向含3molNaClO溶液中通入1mol SO2:3ClO-+H2O+SO2=2HClO+SO42-+Cl-
难度: 中等查看答案及解析
-
分子式为C5H8O3的有机物,既能和NaHCO3溶液反应,又能发生银镜反应的同分异构体有( )种
A. 3 B. 4 C. 5 D. 6
难度: 简单查看答案及解析
-
X、Y、 Z 、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z 、W、R处于同一周期,R与Y处于同一族,Z 、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 元素Y、Z、W形成的简单离子具有相同电子层结构,其半径依次增大
B. 元素Y、R分别与元素X形成的化合物的稳定性: XmY 强于XmR
C. 元素Z、Y形成的1mol化合物中含有的分子数约为1.806×1024
D. 元素Z、R的最高价氧化物水化物之间相互反应生成的盐溶液呈中性或碱性
难度: 中等查看答案及解析
-
已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质(Li+可自由通过),用该电池为电源电解含镍酸性废水并得到单质Ni,实验装置如图所示。下列说法正确的是( )
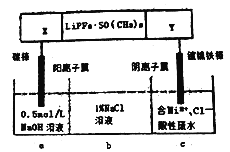
A. 电极X应为Li
B. 电解过程中,b中NaCl 溶液的物质的量浓度将不断减小
C. X 极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式不发生改变
难度: 中等查看答案及解析
-
下列实验操作能达到预期目的的是( )
实验目的
操作
(1)
欲证明CH2=CHCH2OH 中含有碳碳双键
滴入KMnO4酸性溶液,看紫红色是否褪去
(2)
比较水和乙醇中羟基氢的活泼性强弱
用大小相同的金属钠块分别与水和乙醇反应
(3)
比较 AgCl和 AgI 的 Ksp
向AgNO3溶液中加入少量NaCl溶液,充分振荡
后再加入少量NaI 溶液
(4)
证明SO2具有漂白性
将SO2 通入KMnO4 酸性溶液 中
(5)
比较铜和镁的金属活动性强弱
用石墨作电极电解相同浓度Mg(NO3)2、Cu(NO3)2的混合液
(6)
证明Na2CO3溶液中存在水解平衡
在滴有酚酞的Na2CO3溶液中加入BaCl2溶液
A. (2)(5)(6) B. (1)(4)(5) C. (1)(3)(4) D. (2)(3)(6)
难度: 中等查看答案及解析
-
常温下,向20 mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如下图所示,下列说法正确的是( )
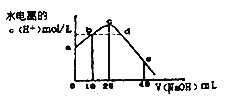
A. b、d两点溶液的pH相同
B. 从a到c,对醋酸的电离既有促进作用也有抑制作用
C. e 点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01mol/L
D. 从a→c的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7mol/L的点
难度: 困难查看答案及解析




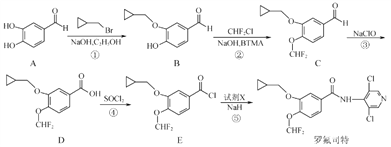
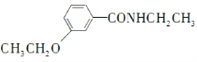 的合成路线流程图(无机试剂任用) ________________________
的合成路线流程图(无机试剂任用) ________________________