-
下列实验操作及现象,能推出相应结论的是
选项
实验操作及现象
结论
A
常温下,用pH计测得0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,前者大
酸性:CH3COOH>HClO
B
向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生
淀粉没有水解
C
向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成;再滴加CuCl2溶液,有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
D
向Fe(NO3)2样品,溶于稀硫酸,滴加KSCN溶液,溶液变红
Fe(NO3)2样品溶于稀硫酸前已氧化变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法正确的是
A. 丙烯和氯乙烯可以合成食品包装材料
B. 蚕丝羊毛、棉花可用来制作纺织品,它们的成分都是蛋白质
C. 用于文物年代鉴定的放射性14C和作为相对原子质量的12C,化学性质不同
D. 将水库的钢闸门与电源负极相连或将锌块焊接于钢闸门上以防止钢闸门生锈
难度: 简单查看答案及解析
-
NA为阿佛加德罗常数的值,下列说法正确的是
A. 2gD2O与2gH218O含有的中子数均为NA
B. 标准状况下2.24LCl2溶于水中达饱和,溶液中HClO分子的数目为0.1NA
C. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数7/22.4)NA
D. 电解饱和食盐水时,用板上生成2.24L气体时转移的电子数为0.1NA
难度: 中等查看答案及解析
-
短同期主族元家X、Y、Z、W、Q的原子序数依次增大,原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,乙是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,X和Z原子序数之和与Q的原子序数相等。下列说法正确的是
A. 气态氢化物的稳定性:X>Y>Q
B. X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C. Z、W、Q三种元素最高价氧化物对应的水化物之间两两均可反应生成盐和水
D. 相同质量的Z和W单质分别与足量稀盐酸反应时,乙的单质制得的氢气多
难度: 中等查看答案及解析
-
利用下列实验装置进行相应的实验,不能达到实验目的的是
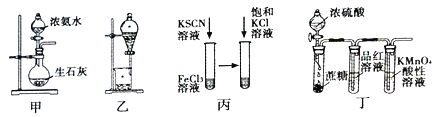
A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙,可验证增加反应物浓度对化学平衡的影响
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性,还原性
难度: 中等查看答案及解析
-
使用新型电极材料,以N2、H2为电极反应物,以溶有M的稀盐酸为电解质溶液,制成新型燃料电池,装置如图所示。下列说法正确的是
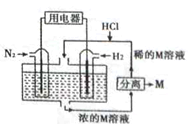
A. 通入H2的一极为正极
B. 放电时H+向左移动,生成的物质M是NH4Cl
C. 通入的电极反成为:N2+6H+-6e-=2NH3
D. 放电过程右边区域溶液pH逐渐增大
难度: 中等查看答案及解析
-
25℃时,将浓度均为0.1mol/L、体积不同的HA溶液与BOH 溶液混合,保持溶液的总体积为100 mL,溶液的体积与混合液pH 的关系如图所示。下列说法正确的是
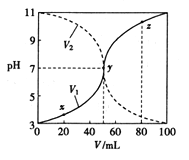
A. V1表示HA 溶液的体积,V2表示BOH 溶液的体积
B. Ka( HA) 和Kb( BOH) 的数量级相等,均为10-6
C. y点时,c(B+)=c(A-)=c(OH-)=c(H+)
D. x、y、z 所示三点时水的电离程度:y>x=z
难度: 困难查看答案及解析
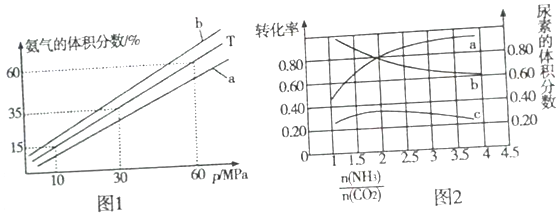

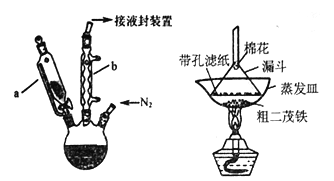
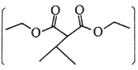 是一种常见的有机合成中间体,在染料、香料、除草剂等的生产中具有广泛的用途,其合成路线如下图所示:
是一种常见的有机合成中间体,在染料、香料、除草剂等的生产中具有广泛的用途,其合成路线如下图所示: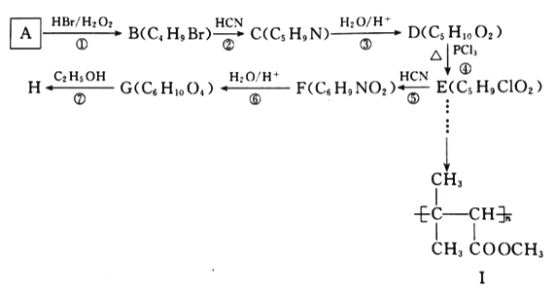
 R-CH2-COOH
R-CH2-COOH