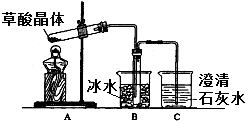
-
新材料的新秀——石墨烯、氧化石墨烯已成为物理、化学、材料科学研究的国际热点课题。其结构模型见下图。下列有关说法正确的是

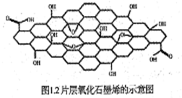
A.石墨烯是一种新型化合物 B.氧化石墨烯即石墨烯的氧化物
C.再者和石墨都是碳的同素异形体 D.氧化石墨烯具有一定的亲水性
难度: 中等查看答案及解析
-
下列有关物质结构(或组成)的表述正确的是
A.中子数为16的硫原子:1632S
B.氯离子的结构示意图:
C.聚苯乙烯结构简式:
D.NH3的电子式:
难度: 简单查看答案及解析
-
下列说法正确的是
A.苯与甲苯互为同系物,均能使KMO4酸性溶液褪色
B.放热反应的反应速率总是大于吸热反应的反应速率
C.氨气具有还原性,可用作制冷剂
D.Na2CO3显碱性,可用其热溶液除去金属餐具表面油污
难度: 简单查看答案及解析
-
在CO2中,Mg燃烧生成MgO和C。下列说法正确的是
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
难度: 中等查看答案及解析
-
短周期元索Q、 W、X、Y、Z的原子序数依次增大,Q原子的最外层电子数是其内层电子数的2倍,X元素的焰色反应显黄色,W、Z原子的最外层电子数相同,Z元索的核电荷数是W的2倍,Y是地壳中含量最多的金属元素。下列说法不正确的是
A.工业上常用电解的方法制备X、Y的单质
B.元素Q和Z能形成QZ2型的共价化合物
C.原子半径的大小顺序:rX>rY>rW>rQ
D.元素X、Y的最高价氧化物的水化物之间能发生反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.中性溶液:Fe3+、K+、Cl-、SO42-
B.
=10-10的溶液:K+、Ba2+、NO3-、Cl-
C.0.1mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
D.与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3-
难度: 困难查看答案及解析
-
下列有关实验的选项正确的是

难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①

②

③

④

⑤

A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO-
B.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.向NH4HCO3溶液中滴加过量NaoH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O
D.NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
难度: 简单查看答案及解析
-
微生物电池是指在微生物的作用下,将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 简单查看答案及解析
-
下列有关说法不正确的是
A.常温常压下,13gZn完全溶于一定量的浓H2SO4中,转移电子数目为0.2mol
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.常温下,0.1mol•L-1 氨水加水稀释后,溶液中
 的值不变
的值不变D.反应3F2(g)+N2(g)=2NF3(g)在常温下能自发进行,则该反应△H< 0
难度: 中等查看答案及解析
-
托卡朋是基于2012年诺贝尔化学奖研究成果开发的治疗帕金森氏病的药物,其部分合成路线如下
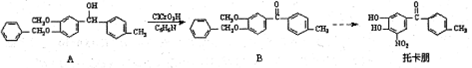
下列说法正确的是
A.托卡朋的分子式为C14H11NO5
B.反应A
B的类型属于消去反应
C.托卡朋分子中所有的碳原子有可能在同平面内
D.1mol托卡朋与足量的浓溴水反应最多消耗1molBr2
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是

难度: 中等查看答案及解析
-
25℃是,向20mL0.1mol•L-1盐酸溶液中逐滴加入等浓度的氨水溶液,溶液中pH与pOH(pOH=一lgc(OH-))的变化关系如图所示。下列说法正确的是
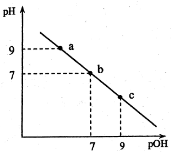
A.b点消耗氨水的体积为20mL
B.向a点所示溶液中加入少量的HCl(aq)或NaOH(aq),溶液的pH变化很少
C.a点和c点所示溶液中水所电离出的c(OH-)分别为10-9mol•L-1和10-5mol•L-1
D.ab段所示溶液中相关料子浓度关系可能为:c(NH4+>c(Cl-)>C(NH3·H2O)
难度: 困难查看答案及解析
-
恒温T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
C2H2(g)+3H2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
5
15
25
35
n(CH4)/mol
1.00
0.84
0.81
0.80
0.80
改变温度,测得不同温度下达平衡时C2H2的物质的量的变化曲线如图.下列说法正确的是
A.温度T时,前5sH2平均速率为0.024mol•L-1•s-1
B.该反应的平衡常数随温度升高逐渐减小
C.温度T时,b点υ(逆)>υ(正)
D.温度为T时,若起始时向容器中充入1.00molC2H2和3.00molH2,达到平衡时,C2H2转化率大于80%
难度: 困难查看答案及解析
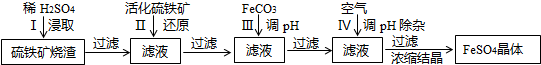
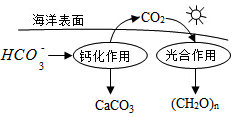
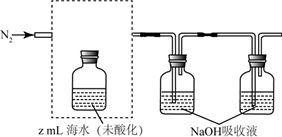
 )是解热镇痛及非甾体抗炎镇痛的一种前体药,广泛适用于各种关节炎以及各种原因引起的疼痛的临床治疗。它的一种合成路线如下:
)是解热镇痛及非甾体抗炎镇痛的一种前体药,广泛适用于各种关节炎以及各种原因引起的疼痛的临床治疗。它的一种合成路线如下:
 )
)