-
下列叙述错误的是( )
A.可用铝制容器盛装稀硫酸
B.Na2O2可用于呼吸面具中作为氧气的来源
C.Fe2O3常用于制造红色油漆和涂料
D.Si可用于制造太阳能电池难度: 中等查看答案及解析
-
下列物质不属于天然高分子化合物的是( )
A.淀粉
B.蚕丝
C.葡萄糖
D.纤维素难度: 中等查看答案及解析
-
生活离不开化学,下列做法不合适的是( )
A.用铝锅长时间存放剩菜
B.用白醋清洗热水瓶中的水垢
C.用碘水检测土豆中含有淀粉
D.利用激光笔区别鸡蛋清和浓盐水难度: 中等查看答案及解析
-
下列物质中属于盐类的是( )
A.乙醇
B.熟石灰
C.胆矾
D.生石灰难度: 中等查看答案及解析
-
下列过程中,不涉及化学变化的是( )
A.甘油加水作护肤剂
B.用明矾净化水
C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
D.烧菜用过的铁锅,经放置常出现红棕色斑迹难度: 中等查看答案及解析
-
下列物质既含有离子键又含有共价键的是( )
A.SO2
B.H2O
C.NaCl
D.NaOH难度: 中等查看答案及解析
-
将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42-浓度为( )
A.0.01 mol/L
B.0.02 mol/L
C.0.03mol/L
D.0.06mol/L难度: 中等查看答案及解析
-
下列实验设计或对实验现象的描述,错误的是( )
A.鉴别氯化钠和氯化钾,用焰色反应
B.盛放氢氧化钠溶液的试剂瓶用橡皮塞
C.用湿润的pH试纸测量某溶液的pH
D.SO2通入品红溶液红色褪去,加热后又出现红色难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是( )
A.H2O的结构式:H-O-H
B.H2O2的电子式:
C.CO2的比例模型:
D.14C的原子结构示意图:
难度: 中等查看答案及解析
-
能与金属钠反应生成H2的有机物是( )
A.CH3CH2OH
B.CH3CH3
C.苯
D.CH3COOCH2CH3难度: 中等查看答案及解析
-
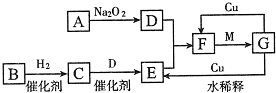
U是制造原子弹的材料和核反应堆的燃料.
U的原子核内的中子数与核外电子数之差是( )
A.235
B.143
C.92
D.51难度: 中等查看答案及解析
-
下列反应中.属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
A.Cl2+H2O⇌HCl+HClO
B.SO2+H2O⇌H2SO3
C.3Fe+4H2O(g)=Fe3O4+4H2
D.2Na+2H2O=2NaOH+H2↑难度: 中等查看答案及解析
-
下列各组离子能在溶液中大量共存的是( )
A.H+、Ca2+、NO3-、CO32-
B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+
D.Cu2+、K+、NO3-、OH-难度: 中等查看答案及解析
-
下列反应属于吸热反应的是( )
A.Ba(OH)2•8H2O与NH4Cl反应
B.镁与盐酸反应
C.盐酸和氢氧化钙溶液反应
D.甲烷的燃烧难度: 中等查看答案及解析
-
下列离子的检验方法和结论正确的是( )
A.向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试液变蓝,则原溶液中一定含有NH4+
B.向某溶液中滴加盐酸酸化过的氯化钡溶液,产生白色沉淀,则原溶液中一定有SO42-
C.向某溶液中滴加稀盐酸产生无色气体,产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32-
D.向某溶液中滴加双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe3+难度: 中等查看答案及解析
-
下列离子离子方程式正确的是( )
A.氢氧化铜与盐酸反应:OHˉ+H+=H2O
B.铁投入稀硫酸中:2Fe+6H+═2Fe3++3H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag
D.碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑难度: 中等查看答案及解析
-
在碘水里加入四氯化碳振荡静置后,分离有机层和水层的实验装置是( )
A.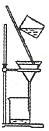
B.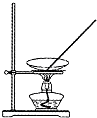
C.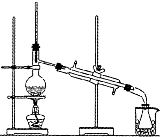
D.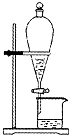
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,4.48L水中含有的分子数目为0.2NA
B.21.3g氯气中含有的Cl原子数目为0.3NA
C.0.2mol•L-1CuCl2溶液中含有Cl-离子的数目为0.4NA
D.0.1 mol钠与足量水反应转移的电子数目为0.1NA难度: 中等查看答案及解析
-
课堂学习中,同学们利用镁条、锌片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论错误的是( )
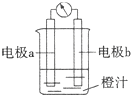
A.原电池是将化学能转化成电能的装置
B.原电池的负极发生氧化反应
C.图中a极为镁条、b极为锌片时,导线中会产生电流
D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片难度: 中等查看答案及解析
-
下列反应属于取代反应的是( )
A.甲烷与氯气在光照条件下生成一氯甲烷
B.乙烯与溴的四氯化碳溶液生成二溴乙烷
C.乙炔与氯化氢反应生成氯乙烯
D.乙醇催化氧化生成乙醛难度: 中等查看答案及解析
-
下列关于化学反应的速率和限度的说法正确的是( )
A.化学反应速率只能用反应物浓度的减少量表示
B.只有温度和催化剂才能影响化学反应速率
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.催化剂既能改变正反应的反应速率,又能改变逆反应的反应速率难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,且原子序数依次增大.已知X的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有一个电子.下列说法正确的是( )
A.最高价氧化物对于水化物的碱性:Z<W
B.原子半径:Z>X
C.气态氢化物的稳定性:X>Y
D.Y与Z能形成共价化合物难度: 中等查看答案及解析
-
某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl-.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至200mL,测得滤液中c(OH-)=0.1mol•L-1;②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35g.关于原溶液组成结论正确的是( )
A.一定含有Mg2+、Al3+、Cl-,不含有Na+、NH4+
B.一定含有Na+、Mg2+、Cl-,不含有NH4+、可能含有Al3+
C.c(Mg2+)为1.00 mol•L-1,c(Na+)为1.50 mol•L-1
D.c(Cl-)为5.00 mol•L-1,c(Al3+)为1.00 mol•L-1难度: 中等查看答案及解析