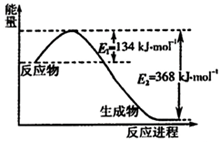
-
下列有关问题,与盐的水解无关的是( )
A.用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
B.用盐酸除铁锈
C.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
D.加热蒸干AlCl3溶液得到Al(OH)3固体难度: 中等查看答案及解析
-
下列实验基本操作正确的是( )
A.用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL
B.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒
C.经实验测定,等物质的量的盐酸、醋酸分别足量NaOH溶液反应放出的热量相等
D.用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6难度: 中等查看答案及解析
-
下列说法正确的是( )
A.升高温度,化学平衡常数一定增大
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.升高温度,活化分子百分数增加,化学反应速率一定增大
D.所有的放热反应都是自发的难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

A.反应的化学方程式为:2M⇌N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍难度: 中等查看答案及解析
-
在下列说法中正确的是( )
A.已知C(s)+O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
B.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
C.1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.同温同压下,已知两个放热反应:2A(l)+B(l)=2C(g)△H1;2A(g)+B(g)=2C(l)△H2,则△H1>△H2难度: 中等查看答案及解析
-
在固定体积的容器内进行反应2AB(g)⇌A2(s)+B2(g,红色)达到平衡状态的标志不正确是( )
A.AB的消耗速率等于A2的消耗速率
B.容器内气体的颜色不再变化
C.容器内气体的压强不再变化
D.单位时间内形成n mol A-A共价键,同时断裂n mol B-B共价键难度: 中等查看答案及解析
-
25℃时,水中存在电离平衡:H2O=H++OH-△H>0.下列叙述正确的是( )
A.将水加热,KW增大,pH不变
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
C.向水中加入少量NH4Cl固体,平衡正向移动,溶液呈碱性
D.向0.1 mol/L的醋酸溶液中加入一定量醋酸钠晶体或加水稀释,溶液中c(OH-)均增大,但KW不变难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等
D.c1的取值范围为0 mol•L-1<c1<0.14 mol•L-1难度: 中等查看答案及解析
-
某原电池的总反应方程式为:2Fe3++Cu═2Fe2++Cu2+,能实现该反应的为( )
A B C D 正极材料 Cu 石墨 Fe Ag 负极材料 Fe Cu Cu Cu 电解质液 CuSO4 Fe2(SO4)3 FeCl3 AgNO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.25℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,因此 AgCl可以转化为AgI
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.某醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液PH<7
C.常温下,1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0
D.若1mLPH=1盐酸与100mLNaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11难度: 中等查看答案及解析
-
关于下列装置说法正确的是( )
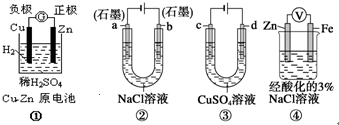
A.装置①中,溶液中的SO42-移向Cu电极
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn沿导线流向Fe,装置中有Fe2+生成难度: 中等查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe.有关该电池的下列说法中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS难度: 中等查看答案及解析
-
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)⇌nC(g)符合图Ⅰ所示关系.由此推断,对图Ⅱ的说法不正确的是( )
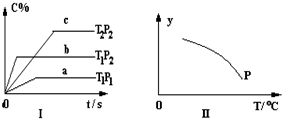
A.Y轴表示A2的转化率
B.Y轴表示C的浓度
C.Y轴表示混合气体的密度
D.Y轴表示混合气体的平均摩尔质量难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.常温下,0.1 mol•L-1的NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO3->c(SO32-)>c(H2SO3)
B.常温下,0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.常温下,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
D.常温下,0.1 mol•L-1的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)难度: 中等查看答案及解析