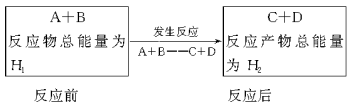
-
下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
难度: 中等查看答案及解析
-
下列说法正确的是
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值
难度: 中等查看答案及解析
-
热化学方程式中化学式的右边要注明物质状态,主要是因为
A.物质呈现的状态与反应热有关
B.可以具体说明反应进行的情况
C.物质呈现的状态与生成什么物质有关
D.说明反应条件
难度: 中等查看答案及解析
-
(双选)下列说法不正确的是
A.化学反应中能量变化多少与反应物的质量有关
B.化学变化中的能量变化都是以热能形式表现出来的
C.在一个确定的化学反应关系中,反应物的总焓与反应产物的总焓一定不同
D.在一个确定的化学反应关系中,反应物的总焓总是高于反应产物的总焓
难度: 中等查看答案及解析
-
已知热化学方程式:H+ (aq) + OH− (aq)
H2O(1) ΔH1=−57. 3 kJ • mol−1
H2SO4 (浓)+NaOH(aq)
Na2SO4 (aq) +H2O(1) ΔH2=m,下列说法正确的是
A.上述热化学方程式中的计量数表示分子数
B.ΔH1>ΔH2
C.ΔH2=−57.3 kJ • mol−1
D.|ΔH1|>|ΔH2|
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是

难度: 中等查看答案及解析
-
在进行中和热的测定中,下列操作错误的是
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
难度: 中等查看答案及解析
-
下列说法不正确的是
A.需要加热才能发生的化学反应不一定是吸热反应
B.放热反应在常温下一定很容易发生
C.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(ΔH)决定
D.化学反应除了生成新的物质外,还伴随着能量的变化
难度: 中等查看答案及解析
-
下列说法中正确的是
A.同温同压下,H2(g)+Cl2(g)
2HCl(g)在光照和点燃的条件下ΔH不相同
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下都能发生
D.化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得
难度: 中等查看答案及解析
-
热化学方程式C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成一氧化碳气体和氢气,并吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸收131.3 kJ热量
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=+1 367.0 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1
难度: 中等查看答案及解析
-
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ/mol
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 452 kJ/mol
难度: 中等查看答案及解析
-
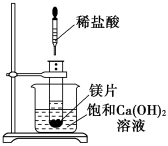
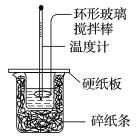
已知在稀溶液中强酸与强碱反应生成1 mol水时放出的热量,叫做中和热,下列说法中正确的是
A.中和热的测定实验中需要用到的主要玻璃仪器有:两只大小相同的烧杯、两只大小相同的量筒、温度计、环形玻璃搅拌棒
B.可以用保温杯来代替烧杯做有关测定中和热的实验
C.在测定中和热的实验中,至少需要测定并记录的温度是2次
D.测定中和热实验中,若所使用的稀NaOH溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是

A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
难度: 中等查看答案及解析
-
下列变化一定为放热的化学反应的是
A.H2O(g)→H2O(l)放出44 kJ热量
B.ΔH>0的化学反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应

难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH−(aq)
H2O(l) ΔH=−57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与1.0 L 0.1 mol·L−1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
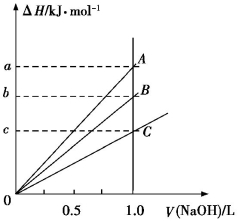
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
难度: 中等查看答案及解析