-
化学在自然资源的开发和利用中具有重要的意义,下列对其认识不正确的是
A.利用化学知识和化学规律,人们可以更好的开发和利用资源
B.利用化学知识和化学规律,人们可以制取更多物质,丰富物质世界
C.人们在开发和利用资源的过程中,对环境造成了污染,化学对此无能为力
D.人们对资源的开发和利用过程中,时刻不能忘记资源的可持续性发展
难度: 中等查看答案及解析
-
日本地震引起的核泄漏中放射性物质主要是Cs和131I,其中有关127I与131I的说法正确的是
A. 127I与131I互为同位素 B. 127I与131I互为同素异形体
C. 127I与131I是同分异构体 D.I与Cl均属ⅦA族,I比Cl活泼
难度: 中等查看答案及解析
-
金属冶炼中不会涉及到的反应类型是
A.氧化还原反应 B.置换反应 C.分解反应 D.复分解反应
难度: 中等查看答案及解析
-
以下是一些分子的比例模型,其中错误的是
A.HCl B.CO2 C.NH3 D.CH4
难度: 中等查看答案及解析
-
下列有关能量转化的认识不正确的是
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理有效
D.燃料燃烧,只是将化学能转化为了热能
难度: 中等查看答案及解析
-
下列物质均有漂白作用,其漂白原理相同的是
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧
A.①②⑤ B.①③⑤ C.②③④ D.①②③
难度: 中等查看答案及解析
-
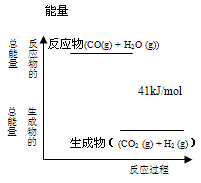
已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是
A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热
B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热
C.若该反应为放热反应,则Q1+Q2<Q3
D.若该反应为吸热反应,则Q1+Q2<Q3
难度: 中等查看答案及解析
-
关于化学键的下列叙述中正确的是
A.离子化合物不含共价键 B.共价化合物可能含有离子键
C.离子化合物中只含离子键 D.共价化合物不含离子键
难度: 中等查看答案及解析
-
下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是
A.碘和干冰的升华 B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化 D.食盐和冰的熔化
难度: 中等查看答案及解析
-
除去CO2中混有的少量SO2气体,最好选用的试剂是
A.澄清石灰水 B.品红溶液 C.水 D.饱和NaHCO3溶液
难度: 中等查看答案及解析
-
Cu粉放入稀H2SO4中,无现象,当再加入一种盐后,Cu粉逐渐溶解,此盐是
A.NaCl B.CuSO4 C.KNO3 D.Na3PO4
难度: 中等查看答案及解析
-
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
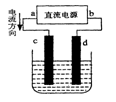
A.d为负极、c为正极
B.c电极上有气体产生
C.电解过程中,Cu2+ 在溶液中向c棒迁移
D.电解过程中,d电极质量不变,氯离子浓度不变
难度: 中等查看答案及解析
-
下图是产生和收集气体的实验装置,该装置最适合于
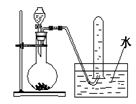
A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取C12
C.用NH4Cl和Ca(OH)2反应制取NH3
D.用H2O2溶液和MnO2反应制取O2
难度: 中等查看答案及解析
-
某透明的酸性溶液中,因发生氧化还原反应而不能大量共存的是
A.NO3-、Cl-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、Cl-
难度: 中等查看答案及解析
-
一定温度下恒容的密闭容器中,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是
A.正反应速率和逆反应速率相等且都为零
B.容器内气体的总压强不随时间变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.容器内气体的平均相对分子质量不随时间变化
难度: 中等查看答案及解析
-
镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是
A.镭的金属性比钙弱 B.单质能与水反应生成H2
C.镭在化合物中呈+2价 D.碳酸镭难溶于水
难度: 中等查看答案及解析
-
在1L 1mol/L的氨水中,下列有关说法正确的是
A.NH3·H2O为1mol ,溶质质量为35g
B.NH4+为1mol ,溶质质量为18g
C.溶解状态的NH3分子为1mol,溶质质量为17g
D.氨水中NH3、NH3·H2O、NH4+三种微粒总的物质的量为1mol
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1:1
难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
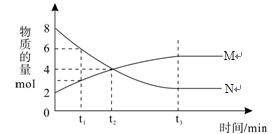
A.反应的化学方程式为:2M
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W离子具有相同的电子层结构,其半径依次增大
B.元素X与元素Y只能形成一种化合物
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物对应水化物都是强酸
难度: 中等查看答案及解析