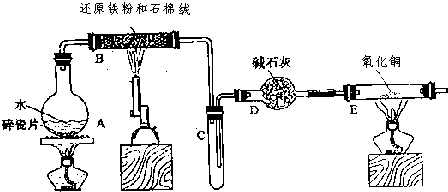
-
24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度为0.02mol/L的K2Cr2O7溶液完全反应.则Cr元素在还原产物中的化合价为( )
A.+2价
B.+3价
C.+4价
D.+5价难度: 中等查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5:3
B.5:4
C.1:1
D.3:5难度: 中等查看答案及解析
-
在下列各组溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:Na+、K+、SO42-、AlO2-
B.含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN-
C.无色透明溶液中:HCO3-、Na+、Cl-、OH-
D.与铝反应生成H2的溶液中:Na+、Cu2+、Cl-、SO42-难度: 中等查看答案及解析
-
世界组织把铝确定为食品污染源之一,应加以控制使用.下列应用时应加以控制的是( )
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药片 ⑦银色漆颜料 ⑧易拉罐 ⑨包装糖果和小食品.
A.③⑤⑧⑨
B.①②⑥⑧⑨
C.③⑤⑨
D.③④⑤⑥⑧⑨难度: 中等查看答案及解析
-
下列实验操作正确的是( )
编号 实验 操作 A 实验室用自来水制备蒸馏水 将自来水倒入烧杯中,小心给烧杯加热 B 配制一定浓度的氯化钾溶液100mL 将称好的氯化钾固体放入100mL容量瓶中,加水溶解,振荡摇匀,定容 C 除去粗盐溶液中的Ca2+、SO42- 依次加入过量的BaCl2溶液、Na2CO3溶液,过滤后再加适量盐酸 D 取出分液漏斗中的上层液体 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
标准状况下mg气体A和ngB气体的分子数相同,下列说法不正确的是( )
A.A与B的相对分子质量之比为m:n
B.同温同压下,两气体A与B的密度之比为n:m
C.同质量的A与B分子个数之比为n:m
D.相同状况下,同体积的气体A与B质量比为m:n难度: 中等查看答案及解析
-
某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性.该学生采用的研究方法是( )
①假说法 ②实验法 ③分类法 ④比较法.
A.①②
B.①③
C.②④
D.①③难度: 中等查看答案及解析
-
小强在奥运五连环中填入了5种物质,使相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数为( )

A.化合反应、3个
B.分解反应、2个
C.复分解反应、1个
D.置换反应、2个难度: 中等查看答案及解析
-
下列化学实验操作或事故处理方法不正确的是( )
A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸
C.酒精灯着火时可用湿布扑灭
D.实验室金属钠着火时可以用干粉灭火器或泡沫灭火器灭火难度: 中等查看答案及解析
-
配制一定物质的量浓度的盐酸溶液时,下列操作可使所配制溶液浓度偏高的是( )
A.用量筒量取浓盐酸俯视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线难度: 中等查看答案及解析
-
下列装置所示的实验能达到实验目的是( )
A.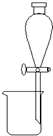
分离碘酒中的碘和酒精
B.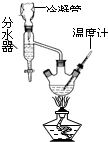
分离沸点不同的两种互溶液体
C.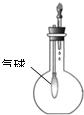
验证NH3的溶解性
D.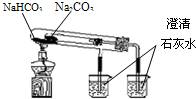
比较Na2CO3、NaHCO3的热稳定性难度: 中等查看答案及解析
-
在下列反应过程中,有3mol电子转移的是( )
A.1mol钠与水反应
B.27g铝与足量盐酸反应
C.22.4L氧气(标准状况)与足量镁反应
D.1.5molNa2O2与足量水反应难度: 中等查看答案及解析
-
向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后,混合液出现红色.那么,由此得出下列的结论错误的是( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Cl2的氧化性强
C.Fe2+被Cl2氧化为Fe3+
D.Fe2+与SCN-不能形成红色的化合物难度: 中等查看答案及解析
-
V mL Al2(SO4)3溶液中含有Al3+a g,取
V mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.mol/L
B.mol/L
C.mol/L
D.mol/L
难度: 中等查看答案及解析
-
下图中是汽车加油站必须贴的标志的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
今有三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和Cl-、I-共存,要氧化除去I-而又不影响Fe2+和Cl-.可加入的试剂是( )
A.Cl2
B.KMnO4
C.FeCl3
D.HCl难度: 中等查看答案及解析
-
将40mlNO2和NO的混合气体通入倒立于水槽中盛满水的试管中,充分反应后试管中剩下20ml气体,则原混合气体中NO2和NO的体积比为( )
A.2:1
B.1:3
C.3:1
D.1:1难度: 中等查看答案及解析
-
将4.6gNa和2.7gAl同时加入到足量的水中充分反应,将反应后的溶液稀释定容为500mL.下列说法不正确的是( )
A.所得溶液中阳离子和阴离子的物质的量之比为1:1
B.反应中消耗的水的质量是加入的Al的质量的2倍
C.所得溶液中AlO2-的物质的量浓度为0.2mol/L
D.反应中放出的气体在标准状况下的体积为2.24L难度: 中等查看答案及解析