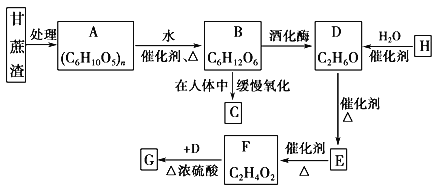
-
化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
A. 能够节约原料和能源 B. 能够提高产品的产量
C. 能够提高经济效益 D. 能够提高化学反应速率
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号
不纯物
除杂试剂
分离方法
A
CH4(C2H4)
酸性KMnO4溶液
洗气
B
苯(Br2)
NaOH溶液
过滤
C
C2H5OH(H2O)
生石灰
蒸馏
D
乙酸乙酯(乙酸)
饱和Na2CO3溶液
蒸馏
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列事实的解释正确的是( )
选项
事实
解释
A
酸雨的pH<5.6
CO2溶解在雨水中
B
氢能是能源开发的研究方向
化石燃料燃烧放出的热量使水分解产生氢气
C
疫苗一般应冷藏存放
避免蛋白质变性
D
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
石油裂化的目的是( )
A. 使长链烃分子断裂为短链烃分子 B. 除去石油中的杂质
C. 使直连烃转化为芳香烃 D. 提高汽油的产量和质量
难度: 简单查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是( )
A. 医疗上判断患者病情时可用新制的Cu(OH)2来测定患者尿液中葡萄糖的含量
B. 蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C. 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D. 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 中等查看答案及解析
-
下列有关化学用语的表示中正确的是 ( )
A. 乙醇分子的球棍模型为

B. 一氯甲烷的电子式为
C. 乙酸的实验式: C2H4O2
D. 分子组成为C5H12的有机物有3种
难度: 简单查看答案及解析
-
在密闭容器中进行X2(g)+2Y2(g)
Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2 mol/L、 0.3 mol/L、0.3 mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
A. c(Z)=0.45 mol/L B. c(X2)=0.3 mol/L c(Z)=0.1 mol/L
C. c(X2)=0.5 mol/L D. c(Y2)=0.5 mol/L
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L二氯甲烷的分子数约为NA个
B. 常温下,在18g 18O2中含有NA个氧原子
C. 1 mol乙烷中含有C—H的键数约为7×6.02×l023
D. 1mol—OH所含的电子数目为7NA
难度: 困难查看答案及解析
-
海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图,下列说法不正确的是( )
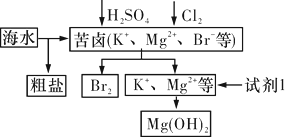
A. 可用BaCl2溶液除去粗盐中的SO
B. 从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2
2Cl-+Br2
C. 试剂1可以选用石灰乳
D. 工业上,通常电解熔融Mg(OH)2来冶炼金属镁
难度: 简单查看答案及解析
-
向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2: Cl-、SO42-、Fe2+、Al3+
B. 加入过量NaOH溶液:SO42-、Na+、AlO2-、OH-
C. 加入过量氨水:NH4+、SO42-、Na+、AlO2-
D. 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+
难度: 困难查看答案及解析
-
化学反应A2 + B2 = 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
难度: 中等查看答案及解析
-
国际能源网报道:金属燃料可能成为新能源,可能带来结束煤、石油能源时代的希望,是一种理想的储能方式,下列说法错误的是
A.金属燃烧后经加工处理后还可生成金属,因此可以重复使用
B.金属燃烧产生的光能,可以通过相关设备转化为电能以充分利用
C.镁、铝是地球上含量丰富的金属元素,且均可以从海水中提取
D.可以利用镁在二氧化碳中燃烧,放出热量的同时收集碳单质
难度: 中等查看答案及解析
-
2018年俄罗斯世界杯比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂一氯乙烷(沸点为12.27 ℃),进行局部冷冻麻醉应急处理。那么制取一氯乙烷(CH3CH2Cl)的最好方法是( )
A. 乙烷与氯气发生取代反应 B. 乙烯与氯气发生加成反应
C. 乙烷与氯化氢反应 D. 乙烯与氯化氢发生加成反应
难度: 困难查看答案及解析