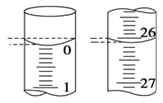
-
化学与生产、生活息息相关,下列叙述错误的是( )
A. 铁表面镀锌可增强其抗腐蚀性
B. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C. 大量燃烧化石燃料是造成雾霾天气的一种重要因素
D. 含重金属离子的电镀废液不能随意排放
难度: 简单查看答案及解析
-
下列与有机物相关的叙述不正确的是( )
A.乙烷和乙烯分别与Cl2反应均有二氯乙烷生成
B.苯滴入溴水振荡后下层液体褪色,该过程发生了加成反应
C.乙醇、乙酸、乙酸乙酯可用饱和碳酸钠溶液鉴别
D.蔗糖和麦芽糖属于同分异构体,一定条件下都可以水解
难度: 中等查看答案及解析
-
运用相关化学知识进行判断,下列结论错误的是
A. 某吸热反应能自发进行,因此该反应是熵增反应
B. NH4F水溶液中含有 HF,因此 NH4F溶液不能存放于玻璃试剂瓶中
C. 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D. 增大反应物浓度可加快反应速率, 则用浓硫酸与铁反应能增大生成 H2的速率
难度: 中等查看答案及解析
-
下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液:c(H+) = c(SO42-) +c(OH-)
B. 含有AgCl和AgI固体的悬浊液:c(Ag+ ) > c(C1-) = c(I-)
C. CO2的水溶液:c(H+) > c(HCO3-) =2c(CO32-)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
难度: 困难查看答案及解析
-
下列实验操作能使实验结果偏低的是
A. 用蒸馏水润湿的pH试纸所测定的某酸溶液的pH
B. 用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度
C. 用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol·L-1H2SO4溶液的浓度
D. 用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度
难度: 中等查看答案及解析
-
二氧化硫的催化氧化原理为2SO2(g)+O2(g)
2SO3(g),反应混合体系在平衡状态时SO3的体积分数与温度的关系如图所示,下列说法错误的是( )
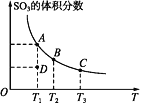
A. 在D点时v(正)<v(逆)
B. 反应2SO2(g)+O2(g)
2SO3(g)的ΔH<0
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
难度: 中等查看答案及解析
-
下列与装置有关的说法正确的是( )
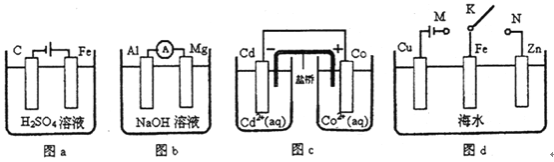
A. 图a中,随着电解的进行溶液中H+的浓度越来越大
B. 图b中,Mg电极作电池的负极
C. 图c中,发生的反应为Co+Cd2+= Cd+Co2+
D. 图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀
难度: 中等查看答案及解析