-
下列说法中正确的是( )
A. 同一原子中,1s、2s、3s电子的能量逐渐减小
B. 3p2表示3p能级有两个轨道
C. 处于最低能量状态的原子叫做基态原子
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 简单查看答案及解析
-
下列说法不正确的是:( )
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.活化分子的平均能量与所有分子的平均能量之差称为活化能
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
难度: 简单查看答案及解析
-
有关杂化轨道理论的说法不正确的是( )
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形的结构可以用sp3杂化轨道解释
D.杂化轨道全部参加形成化学键
难度: 中等查看答案及解析
-
已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是( )
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
难度: 简单查看答案及解析
-
下列各组物质的晶体中,所含化学键类型全部相同,熔化时所克服的作用力也完全相同是( )
A.CO2和SiO2 B.NaCl和HCl
C.(NH4)2CO3和CO(NH2)2 (尿素) D.NaH和KCl
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.非极性分子中一定含有非极性键
D.元素的非金属性越强,其单质的活泼性一定越强
难度: 中等查看答案及解析
-
只有阳离子而没有阴离子的晶体是( )
A.金属晶体 B.原子晶体 C.离子晶体 D.分子晶体
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.BeCl2与BF3 B.CO2与SO2
C.CCl4与NH3 D.C2H2和C2H4
难度: 中等查看答案及解析
-
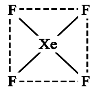
三氯化磷分子的空间构型是三角锥形而不是平面正三角形。下列关于三氯化磷分子空间构型理由的叙述,正确的是:( )
A.PCl3分子中三个共价键的键长相等
B.PCl3分子中的P—Cl键属于极性共价键
C.PCl3分子中三个共价键的键长、键角均相等,
D.PCl3分子中P—Cl键的三个键的键长相等,且属于极性分子
难度: 中等查看答案及解析
-
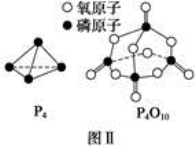
NA为阿伏加德罗常数,下列说法正确的是( )
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为3NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60 g SiO2中含Si—O键的个数为2NA
难度: 中等查看答案及解析
-
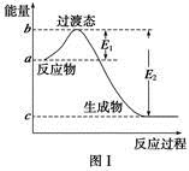
按照反应Br+H2
HBr+H的能量变化示意图,下列叙述正确的是( )

A.该反应的ΔH=+(E1-E2)kJ·mol-1
B.加入催化剂,该化学反应的反应热变大
C.反应物的总能量高于生成物的总能量
D.该反应为放热反应
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W原子序数依次增大,X原子2p能级的3个轨道上都有电子且轨道上有2个未成对电子,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族。下列说法正确的是( )
A. 元素的非金属性:X<W
B. 原子半径:Y<Z<W
C. 单质的还原性:Y>Z
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
下列热化学方程式中,△H能正确表示物质的燃烧热的是
( )
A.CO(g) +1/2O2(g) =CO2(g) △H=-283.0 kJ/mol
B.C(s) +1/2O2(g) =CO(g) △H=-110.5 kJ/mol
C.H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) △H=-11036 kJ/mol
难度: 中等查看答案及解析
-
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,甲充有二氧化氮(N2O4
2NO2 △ H > 0);乙充有空气,现分别进行下列两个实验:
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
难度: 困难查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A.υ(D)=0.4 mol/( L·s) B.υ(C)=0.5 mol/( L·s)
C.υ(B)=0.6 mol/( L·s) D.υ(A)=0.15 mol/( L·s)
难度: 中等查看答案及解析
-
在体积为VL的密闭容器中存在化学平衡:2NO2(g)
N2O4(g),ΔH<0。保持温度不变,将容器体积压缩至V/2后,下列说法不正确的是( )
A.容器内气体颜色变深 B.容器内NO2分子数减少
C.混合气体的平均相对分子质量增大 D.NO2的物质的量分数增大
难度: 中等查看答案及解析