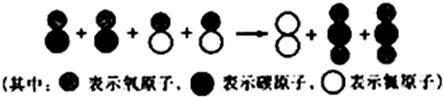-
鉴别下列各组物质,选用试剂或方法(括号内)正确的是( )
A.水和过氧化氢溶液(二氧化锰)
B.纯碱和烧碱溶液(酚酞)
C.生石灰和氢氧化钠固体(水)
D.CO2和N2(燃着的木条)难度: 中等查看答案及解析
-
将下列四种家庭常用的调味品分别放入水中,不能形成溶液的是( )
A.芝麻油
B.食盐
C.味精
D.蔗糖难度: 中等查看答案及解析
-
我国盛产的香料八角中存在莽草酸(化学式为C7H10O5),由它合成的达菲(化学式为C16H31O8N2P)是抗甲型H1N1流感的一种药物.下列说法正确的是( )
A.莽草酸属于氧化物
B.莽草酸中碳、氢、氧的质量比为7:10:5
C.达菲的相对分子质量为174
D.用莽草酸合成达菲时需要含氮的物质难度: 中等查看答案及解析
-
能证明分子在化学变化中可分的是( )
A.打开汽水瓶,有气体逸出
B.10mL水与10mL酒精混合,体积小于20mL
C.加热氧化汞得银白色汞与氧气
D.水蒸发为水蒸气难度: 中等查看答案及解析
-
推理是化学学习中常用的思维方法.下列推理正确的是( )
A.酸能使紫色石蕊变红,通入CO2后的紫色石蕊溶液变红,说明CO2属于酸
B.中和反应产生盐和水,Fe2O3与盐酸反应生成盐和水,该反应属于中和反应
C.碱溶液的pH大于7,碳酸钠溶液的pH大于7,所以碳酸钠属于碱
D.氧化物由两种元素组成且其中一种是氧元素,水由氢、氧元素组成,水属于氧化物难度: 中等查看答案及解析
-
现用98%的浓硫酸配制1000mL溶质质量分数为20%的稀硫酸(密度为1.14g/mL).下列说法正确的是( )
A.配制时应将水小心地加入浓硫酸中
B.该稀硫酸中,溶剂质量:溶质质量=5:1
C.实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管等
D.配制该稀硫酸需要加水800mL难度: 中等查看答案及解析
-
下列各组物质发生的变化,均属于化学变化的是( )
A.木炭在空气中燃烧,发光、放热;灯泡通电,发光、放热
B.少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后不见了
C.澄清石灰水中通入适量二氧化碳后变浑浊;澄清的饱和石灰水加热升温后变浑浊
D.块状生石灰在空气中逐渐变为白色粉末;镁带在空气中燃烧后变为白色粉末难度: 中等查看答案及解析
-
某种元素的化合价在化学反应前后发生了变化,则该反应为氧化还原反应.据此可判断下列化学反应属于氧化还原反应的是( )
A.Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
B.Fe2O3+3CO═2Fe+3CO2
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑
D.H2CO3=H2O+CO2↑难度: 中等查看答案及解析
-
在一个密闭的容器内有甲、乙、丙、丁四种物质,通过电火花引燃后,充分发生反应.经测定,容器内反应前后各物质的质量如下:
若甲的相对分子质量为n,丁的相对分子质量为2n,则下列说法正确的是( )物质 甲 乙 丙 丁 反应前质量/g 4 10 1 25 反应后质量/g 未测 21 10 9
A.该反应一定是置换反应
B.该反应中生成乙与丁的质量比为21:10
C.甲反应后的质量为4g
D.该反应中甲与丁的化学计量数之比为1:2难度: 中等查看答案及解析
-
下列各组物质在溶液中能大量共存的一组是( )
A.Na2CO3、NaHCO3、HCl
B.NaCl、AgNO3、HNO3
C.NaNO3、KCl、NaOH
D.Ca(OH)2、BaCl2、H2SO4难度: 中等查看答案及解析
-
环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了对生活垃圾分类投放的办法,其中塑料袋、废纸、旧橡胶制品等属于( )
A.非金属单质
B.盐类
C.有机物
D.无机物难度: 中等查看答案及解析
-
2009年12月在哥本哈根召开了联合国气候变化大会,“低碳生活”成为热门话题,下列减缓全球气候变暖的对策中,不恰当的是( )
A.提倡乘坐公共交通工具、骑自行车或步行的方式出行
B.广泛使用一次性筷子、一次性塑料袋
C.在生产和生活中提倡使用节能技术和节能用具
D.开发无污染的太阳能、风能、地热能等难度: 中等查看答案及解析
-
铜和铝是日常生活和生产中重要的金属.钛(Ti)有许多神奇的性能,越来越引起人们的关注,是21世纪的重要金属之一.依据三种金属的性质和用途,判断下列说法错误的是( )
A.铝是地壳中含量最多的金属元素
B.将大小、厚薄相同的铜、铝、钛分别放入等质量、等浓度的稀盐酸中,观察到钛表面缓慢放出气泡,铝的放出气泡较快,而铜的无现象,由此可推测三种金属的活动性顺序为Al>Cu>Ti
C.钛或钛合金放到海水中数年后仍光亮如初,这说明原因是金属钛具有很强的抗腐蚀性
D.高层建筑常采用铝合金门窗而不采用铁门窗,主要原因是铝的密度小且表面易形成一层致密的氧化物薄膜难度: 中等查看答案及解析
-
下列生活小实验不能成功的是( )
A.用食醋除去水壶中的水垢
B.用灼烧的方法区分羊毛和涤纶
C.用紫卷心菜等自制酸碱指示剂
D.用食盐水区分硬水和饮用纯净水难度: 中等查看答案及解析
-
使用灭火器扑灭图书档案、贵重设备、精密仪器等火灾时,最好不要留下任何痕迹,下列灭火器中最适宜的是( )
A.干粉灭火器
B.泡沫灭火器
C.高压水枪
D.液态二氧化碳灭火器难度: 中等查看答案及解析
-
可以用加热氯酸钾和二氧化锰混合物的方法在实验室制取氧气.下列是反应生成氧气和氯化钾的质量与反应时间的关系坐标图,其中合理的是( )
A.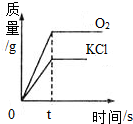
B.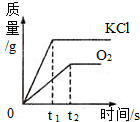
C.
D.
难度: 中等查看答案及解析
-
集气瓶(或广口瓶) 的用途广泛.对于下列所示实验中,其解释不正确的是( )
A B C D 实
验
装
置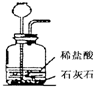
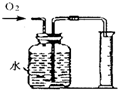

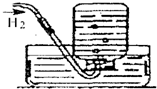
解
释用于制取二氧化
碳的发生装置用于测量产生氧
气体积的装置用于干燥氨气
的装置用于排水法收集氢气的装置
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
绿色化学是指用化学的技术和方法去减少或杜绝对人类健康、生态环境有害物质的产生,尽可能减少对环境的负作用.下列化学反应,不符合“绿色化学”概念的是( )
A.消除硫酸厂尾气排放的SO2:SO2+2NH3+H2O=(NH4)2SO3
B.消除制硝酸工业尾气氮的氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O
C.制取硫酸铜:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.制取硝酸铜:2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O难度: 中等查看答案及解析
-
下列各组物质之间的反应,需要借助无色酚酞试液判断出反应发生的是( )
A.镁和稀盐酸
B.氢氧化钙溶液和稀盐酸
C.铝和硫酸铜溶液
D.碳酸钡和稀盐酸难度: 中等查看答案及解析
-
现有100 gCuSO4和ZnSO4的混合溶液,向其中加入5.6 g铁粉,恰好完全反应后,过滤,则溶液的质量变化情况以及滤液中的金属离子判断正确的是( )
A.质量变大,Zn2+、Fe2+
B.质量变大,Cu2+、Zn2+
C.质量变小,Zn2+、Fe2+
D.质量变小,Cu2+、Fe2+难度: 中等查看答案及解析